1、选择题 下列除去杂质的方法错误的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:A.SiO2不溶于盐酸,Fe2O3可溶于盐酸,然后用过滤分开,故A正确;
B.Mg不与NaOH反应,铝可与NaOH反应,然后用过滤分开,故B正确;
C.Mg可与FeCl2和FeCl3反应,将原物质除掉,不符合除杂原则,故C错误;
D.温度降低,氯化钾的溶解度的变化很小;但是温度降低,硝酸钾的溶解度下降非常大.所以随着温度的降低硝酸钾就会结晶析出,而氯化钾仍然溶解在水中,故D正确.
故选C.
点评:本题考查物质的分离、提纯和除杂,题目难度不大,本题注意除杂时不能引入新的杂质,且不能影响被提纯的物质的量.
本题难度:困难
2、选择题 下列实验中操作及现象与结论对应关系正确的一组是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A、二氧化碳和氯化钡溶液不能发生反应;
B、二氧化硫具有还原性,易被溴单质氧化为硫酸;
C、氯气具有氧化性,能将碘离子氧化为碘单质,碘溶于四氯化碳中显示紫红色;
D、醛和新制氢氧化铜悬浊液的反应需要在碱性环境下才能发生.
解答:A、二氧化碳和氯化钡溶液不能发生反应,只有在碱性环境下才能发生反应生成碳酸钡沉淀,故A错误;
B、二氧化硫具有还原性,易被溴单质氧化为硫酸,溴单质同时被还原为溴离子,而褪色,体现了二氧化硫的还原性,故B错误;
C、氯气具有氧化性,能将碘离子氧化为碘单质,碘溶于四氯化碳中显示紫红色,可以用此现象检验碘离子的存在,故C正确;
D、淀粉和稀硫酸混合共热后,加入过量的氢氧化钠中和硫酸,再加少量新制氢氧化铜悬浊液,如果产生红色沉淀,可以证明淀粉水解可生成葡萄糖,故D错误.
故选C.
点评:本题考查化学实验方案的评价,注意物质的性质和物质的检验方法,排除其它因素的干扰是关键,难度较大.
本题难度:困难
3、选择题 某学生要配置100ml.0.5mol.L-1NaCl溶液,不需要的仪器是
A.250ml容量瓶
B.胶头滴管
C.烧杯
D.玻璃棒
参考答案:A
本题解析:分析:配制100ml.0.5mol.L-1NaCl溶液需要的仪器有100mL容量瓶、玻璃棒、胶头滴管、烧杯、若用固体配制还需要托盘天平等.
解答:配制100ml.0.5mol.L-1NaCl溶液需要的仪器有100mL容量瓶、玻璃棒、胶头滴管、烧杯、若用固体配制还需要托盘天平,故不需要250mL容量瓶,故选A.
点评:考查一定物质的量浓度溶液的配制,比较基础,注意掌握溶液配制的操作.
本题难度:困难
4、选择题 下列有关溶液的说法中,正确的是
A.含H+的溶液显酸性,含OH-的溶液显碱性
B.用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体
C.某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
D.标准状况下,2.24?L?NH3溶于水制得1L氨水,则c?(NH3?H2O)=0.1mol?L-1
参考答案:B
本题解析:分析:A.溶液的酸碱性取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小;
B.胶体有丁达尔效应;
C.在不指明温度的情况下饱和与不饱和溶液溶质质量分数无法比较;
D.NH3?H2O是弱电解质.
解答:A.判断溶液的酸碱性应根据溶液中氢离子浓度与氢氧根离子浓度的相对大小判断,故A错误;
B.溶液无丁达尔效应,胶体有丁达尔效应,可用丁达尔效应可以区别溶液与胶体,故B正确;
C.在不指明温度的情况下饱和与不饱和溶液溶质质量分数无法比较大小,相同温度饱和溶液一定比不饱和溶液质量分数要大,故C错误;
D.NH3?H2O是弱电解质,能发生部分电离,浓度小于0.1mol?L-1,故D错误.
故选B.
点评:本题考查酸碱的定义、胶体的性质、饱和溶液、弱电解质的电离等,难度不大,注意溶液的酸碱性取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小.
本题难度:一般
5、选择题 设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1?mol?Na202和水完全反应,转移的电子数为2NA
B.0.5?L?0.2?mol/L?FeCl3溶液中,含有的Fe3+数为0.1NA
C.在一定条件下,催化分解80?g?S03,混合气体中氧原子数为3NA
D.常温常压下,28?g乙烯和丙烯混合气体中含有的碳原子总数为2.5NA
参考答案:C
本题解析:分析:A、依据过氧化钠和水反应是自身氧化还原反应,氧元素化合价从-1价变化为0价和-2价;
B、水溶液中铁离子水解;
C、依据元素守恒分析;
D、乙烯和丙烯最简式相同,为CH2,计算28gCH2中碳原子数.
解答:A、过氧化钠和水反应是自身氧化还原反应,氧元素化合价从-1价变化为0价和-2价,1 mol Na202和水完全反应,转移的电子数为NA,故A错误;
B、0.5 L 0.2 mol/L FeCl3溶液中,铁离子水解,含有的Fe3+数小于0.1NA,故B错误;
C、催化分解80 g S03,混合气体中氧原子数守恒为3mol,即为3NA,故C正确;
D、乙烯和丙烯最简式相同,为CH2,计算28gCH2中碳原子数=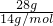 ×1×NA=2NA,28 g乙烯和丙烯混合气体中含有的碳原子总数为2NA,故D错误;
×1×NA=2NA,28 g乙烯和丙烯混合气体中含有的碳原子总数为2NA,故D错误;
故选C.
点评:本题考查了氧化还原反应电子转移计算,盐类水解的分析,原子守恒的应用,质量换算物质的量计算微粒数,题目难度中等.
本题难度:简单