1、选择题 不能用排空气法收集的气体是
A.CO2
B.NO2
C.NO
D.H2
参考答案:C
本题解析:分析:能用排空气法收集的气体应满足:通常条件下不与氧气反应,且密度与空气不相等,一般相差较大.
解答:A、CO2密度比空气大,不与氧气反应,可以用排空气法收集,故A正确;
B、NO2密度比空气大,不与氧气反应,可以用排空气法收集,故B正确;
C、NO与氧气反应生成NO2,不可以用排空气法收集,故C错误;
D、通常条件下H2不与氧气反应,可以用排空气法收集,故D正确;
故选C
点评:本考点考查了常见气体的收集,气体的收集方法有:排水法和排空气法,排水法适用于不易溶于水或难溶于水的气体;排空气法分为向上排空气法和向下排空气法,向上排空气法适用于密度比空气大的气体,向下排空气法适用于密度比空气小的气体.
本题难度:一般
2、选择题 与3.2克SO2所含的氧原子数相等的NO质量为
A.6.4克
B.3.2克
C.4.6克
D.3.0克
参考答案:D
本题解析:分析:根据n= 计算3.2克SO2的物质的量,氧原子数目相等则2n(SO2)=n(NO),据此计算NO的物质的量,在根据m=nM计算NO的质量.
计算3.2克SO2的物质的量,氧原子数目相等则2n(SO2)=n(NO),据此计算NO的物质的量,在根据m=nM计算NO的质量.
解答:3.2克SO2的物质的量为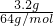 =0.05mol,氧原子数目相等则2n(SO2)=n(NO),所以n(NO)=2n(SO2)=2×0.05mol=0.1mol,所以NO的质量为0.1mol×30g/mol=3g.
=0.05mol,氧原子数目相等则2n(SO2)=n(NO),所以n(NO)=2n(SO2)=2×0.05mol=0.1mol,所以NO的质量为0.1mol×30g/mol=3g.
故选:D.
点评:考查常用化学计量的有关计算,比较基础,注意公式的掌握与灵活运用.
本题难度:一般
3、选择题 在含有MgCl2、KCl、NaSO4三种物质的混合溶液中,已知各离子的物质的量浓度分别为C(Cl-)=1.5mol/L,C(K++Na+)=1.5mol/L,C(SO42-)=0.5mol/L,则C(Mg2+)应是
A.0.1?mol/L
B.1.5?mol/L
C.0.25?mol/L
D.0.5?mol/L
参考答案:D
本题解析:分析:混合溶液呈电中性,根据电荷守恒有c(Cl-)+2(SO42-)=c(K+)+c(Na+)+2c(Mg2+),据此计算.
解答:混合溶液呈电中性,根据电荷守恒有c(Cl-)+2(SO42-)=c(K+)+c(Na+)+2c(Mg2+),故:
1.5mol/L+2×0.5mol/L=1.5mol/L+c(Mg2+)
解得:c(Mg2+)=0.5?mol/L,
故选D.
点评:本题考查物质的量浓度的有关计算,难度中等,注意电解质混合溶液中离子浓度的计算,经常利用电荷守恒计算.
本题难度:简单
4、选择题 除去下列物质中少量杂质采用的方法与制取无水乙醇的方法相同的是
A.己烷(杂质为己烯)
B.乙醇(杂质为乙酸)
C.硝基苯(杂质为苯)
D.苯(杂质为甲苯)
参考答案:B
本题解析:分析:乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇.
解答:A.己烷(杂质为己烯)方法是:可以用溴水洗涤,故A错误;
B.乙醇(杂质为乙酸)方法是:加入氧化钙蒸馏,故B正确;
C.硝基苯(杂质为苯)方法是:蒸馏,故C错误;
D.苯(杂质为甲苯)方法是:可以用酸性高锰酸钾溶液氧化除去,故D错误.
故选B.
点评:本题考查物质的分离提纯,题目难度不大,注意根据物质的性质差异性选择物理或化学方法进行分离.
本题难度:困难
5、选择题 可以用酒精灯直接加热的玻璃仪器是
A.蒸发皿
B.烧瓶
C.锥形瓶
D.试管
参考答案:D
本题解析:分析:可直接加热的仪器有:试管、燃烧匙、蒸发皿、坩埚.
解答:可直接加热的仪器中,只有试管是玻璃仪器.所以可以直接在酒精灯火焰上加热的玻璃仪器是试管.
故选D.
点评:本题考查能直接加热的玻璃仪器,难度不大,注意可直接加热的仪器有:试管、燃烧匙、蒸发皿、坩埚.
本题难度:困难