1、计算题 (4分)某同学为了测定镁铝合金中镁的质量分数,取3.9克镁铝合金投入足量的盐酸中,测得生成气体的体积为4.48L(标准状况),请计算该合金中镁的质量分数。(假设合金中不含其它金属)
参考答案:30.8%
本题解析:设镁的物质的量为xmol,铝的物质的量为ymol。
则有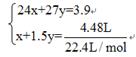 解得x=0.05mol,y=0.15mol。
解得x=0.05mol,y=0.15mol。
所以镁的质量分数为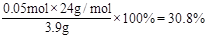 ?
?
点评:本题很基础,难度小。
本题难度:一般
2、填空题 (8分)(1)两个同容积的密封容器A、B,常温下,A中充入a g A气体,B中充入a g CH4气体,A与B内的压强之比是4∶11,则A的摩尔质量为_________________。
(2)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl-
的物质的量为?。
(3)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ mL),所得溶液的密度为ρ g/ mL, 则该溶液的溶质的物质的量浓度为??。?
(4)在 11P + 15 CuSO4 +24 H2O =" 5" Cu3P +6 H3PO4 +15 H2SO4中,每 1 mol CuSO4可以氧化磷的物质的量是 __________ 。
参考答案:(每空2分,共8分)
(1)44 g/mol?(2)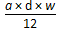 mol?(3)C=1000Vρ/(17V+22400)mol/L
mol?(3)C=1000Vρ/(17V+22400)mol/L
(4)1/5mol
本题解析:略
本题难度:一般
3、计算题 (4分)已知CO和CO2的混合气体14.4g在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为?g,CO2的物质的量为?mol
参考答案:5.6; 0.2
本题解析:设CO质量为xg,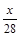 +
+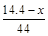 =
=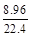 ,x=5.6。二氧化碳质量为8.8g,物质的量为0.2mol。
,x=5.6。二氧化碳质量为8.8g,物质的量为0.2mol。
点评:物质的量计算公式的灵活运用。
本题难度:一般
4、选择题 月壤中的3He是核聚变发电最清洁最安全的理想物质,地球上氦元素主要以4He形式存在,3He仅有15 t左右;而月球上的3He有数百万吨之多,可供全世界开采500年。下列说法正确的是( )
①3He、4He的化学性质基本相同 ②3He、4He具有相同的中子数 ③3He核聚变是化学变化 ④3He液化是物理变化 ⑤3He、4He形成的单质中均含有共价键 ⑥3He、4He分别组成的气体单质,在相同条件下密度之比为3∶4
A.①②⑤
B.①④⑥
C.②③⑤
D.①③⑥
参考答案:B
本题解析:: 3He和4He互为同位素,它们的质子数和核外电子数相等,其最外层电子数均为2,故它们的化学性质基本相同,故①是正确的;它们的中子数分别为1和2,即②是错误的;3He的核聚变不是化学变化,因为化学变化中原子核是不能发生改变的,故③是错误的;液化是物理变化,故④是正确的;稀有气体是单原子分子,其分子内不存在化学键,因此⑤是错误的;在相同的条件下,气体的密度之比等于其相对分子质量之比,因此3He、4He分别组成的气体单质,在相同条件下密度之比为3∶4,即⑥是正确的。
本题难度:一般
5、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为( )

A.1∶1∶1
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
参考答案:D
本题解析:氧化性由强到弱的顺序为:HNO3>Fe3+>Cu2+,则随铁粉增加,反应分别为:
4HNO3(稀)+Fe Fe(NO3)3+NO↑+2H2O
Fe(NO3)3+NO↑+2H2O
2Fe(NO3)3+Fe 3Fe(NO3)2
3Fe(NO3)2
Cu(NO3)2+Fe Fe(NO3)2+Cu
Fe(NO3)2+Cu
所以原溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量之比为:(2-1)∶1∶4=1∶1∶4。
本题难度:一般