1、选择题 某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)= c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
c(Na+)=c(SO42-)(c表示物质的量浓度),则其溶质可能是
A.KCl、Na2SO4
B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4
D.KCl、K2SO4、Na2SO4
参考答案:AC
本题解析:A、若KCl、Na2SO4的物质的量相同时,则电离生成的离子关系为 c(K+)=c(Cl-)= c(Na+)=c(SO42-),故A正确;B、若c(K+)=c(Cl-),则该溶液中溶质不可能有氯化钠,故B错误;C、若c(K+)=c(Cl-),则硫酸钾的物质的量是氯化钠的2倍。则只要在满足硫酸钠的物质的量等于硫酸钾即可满足c(K+)=c(Cl-)=
c(Na+)=c(SO42-),故A正确;B、若c(K+)=c(Cl-),则该溶液中溶质不可能有氯化钠,故B错误;C、若c(K+)=c(Cl-),则硫酸钾的物质的量是氯化钠的2倍。则只要在满足硫酸钠的物质的量等于硫酸钾即可满足c(K+)=c(Cl-)= c(Na+)=c(SO42-)成立,故C正确;D、KCl、K2SO4、无论以何种比例混合,都c(K+)>c(Cl-),因此不会满足C c(K+)=c(Cl-)=
c(Na+)=c(SO42-)成立,故C正确;D、KCl、K2SO4、无论以何种比例混合,都c(K+)>c(Cl-),因此不会满足C c(K+)=c(Cl-)= c(Na+)=c(SO42-),故D错误,答案选AC。
c(Na+)=c(SO42-),故D错误,答案选AC。
本题难度:一般
2、选择题 在下列三个实验中:①配制一定物质的量浓度的溶液?②蒸发?③过滤,均要用到的仪器是
A.试管
B.胶头滴管
C.玻璃棒
D.漏斗
参考答案:C
本题解析:解答:①配制一定物质的量浓度的溶液,用到的仪器有:天平、烧杯、玻璃棒、胶头滴管以及容量瓶等;
②蒸发用到铁架台、酒精灯、蒸发皿、玻璃棒等仪器.
③过滤用到烧杯、玻璃棒、漏斗等仪器;以上操作都用到了玻璃棒.
故选C.
本题难度:简单
3、填空题 CO、CH4均为常见的可燃性气体。
120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
(1)若混合气体与氧气恰好完全反应,产生bmL二氧化碳,混合气体中一氧化碳和甲烷的物质的量之比为: ;混合物中甲烷的质量分数为: 。
(2)若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是 。
参考答案:(9分)(1)2:1 22.2%(2)b≥5a/4
本题解析:(1)根据方程式2CO+O2 2CO2、CH4+2O2
2CO2、CH4+2O2 CO2+2H2O,可知当产生的二氧化碳与消耗的氧气的体积相同时CO与CH4的物质的量之比是2:1;则混合气体中甲烷的质量分数是16/(2×28+16) ×100%=22.2%;
CO2+2H2O,可知当产生的二氧化碳与消耗的氧气的体积相同时CO与CH4的物质的量之比是2:1;则混合气体中甲烷的质量分数是16/(2×28+16) ×100%=22.2%;
(2)120℃、101 kPa下水是气体,甲烷燃烧后的气体的体积不变,设CO为xml,CH4为yml,则
2CO+O2 2CO2 △V
2CO2 △V
x x/2 x x/2
CH4+2O2 CO2+2H2O,
CO2+2H2O,
y 2y y
则x+y=a,x/2+2y≤b,x/2=a/4,三式联立解得b≥5a/4
考点:考查化学方程式的计算
本题难度:困难
4、选择题 现需要物质的量浓度约为2 mol·L-1的NaOH溶液100 mL,下面的操作正确的是(? )
A.称取7.8 g Na2O2固体,放入250 mL烧杯中,用100 mL 量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用另一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
参考答案:D
本题解析:A不正确,因为过氧化钠要消耗水;B不正确,量筒不能稀释溶液;同样容量瓶也不能稀释溶液,C不正确,因此正确的答案选D。
本题难度:一般
5、实验题 下图是硫酸试剂瓶标签上的内容。
硫酸:化学纯(CP)(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g·cm-3
质量分数:98%
|
(1)该硫酸的物质的量浓度为 ;
(2)实验室用该硫酸配制240mL 0.46mol/L的稀硫酸,则
①有以下仪器: A.烧杯 B.100mL量筒 C.250mL容量瓶 D.500mL容量瓶 E.玻璃棒 F.托盘天平(带砝码)G.10mL量筒H.胶头滴管,配制时,必须使用的仪器有 (填代号).
②需要该硫酸的体积为 mL.
③下图为配制过程中的几个关键步骤和操作:将上述实验步骤A—F按实验过程
先后次序排列 。
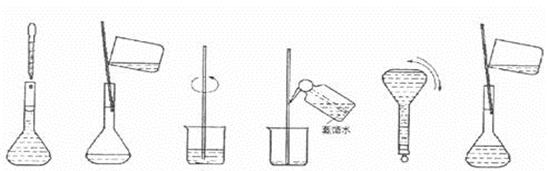 A B C D E F
A B C D E F
④该同学实际配制得到的浓度为0.45mol/L,可能的原因是
A.量取浓H2SO4时仰视刻度
B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶
D.定容时仰视刻度
参考答案:(1)18.4mol/L (2分,单位没有给1分);
(2)①ACEGH;(2分,多选不给分)②6.25或6.3ml(2分);
③CBDFAE(2分,有次序错就全错)④C、D(2分,漏选扣1分)
本题解析:(1)由溶质的质量分数求物质的量浓度时可依据公式c=1000ρω/M来计算,代入数据可求得,c=18.4mol·L-1。
(2)①配制240mL 0.46mol/L的稀硫酸,需要使用250ml容量瓶,量取浓硫酸使用10ml量筒,在烧杯中溶解,溶解和移液用玻璃棒,定容用胶头滴管,故选用ACEGH。
②由稀释前后溶质的物质的量不变可知,18.4mol·L-1×V=4.6mol·L-1×0.25 L,则V=0.063 L=6.3ml。
③按照溶解、转移、洗涤、定容、摇匀的顺序进行排列,故正确顺序为:CBDFAE。
④实际配制得到的浓度为0.45mol/L,浓度变小,A、量取浓H2SO4时仰视刻度,造成H2SO4量取的体积增大,配制溶液的浓度增大;B、容量瓶未干燥,不影响浓度;C、没有将洗涤液转入容量瓶,造成溶质减小,浓度偏小;D、定容时仰视刻度,造成溶液体积变大,配制的溶液浓度减小。
考点:本题考查配制一定物质的量浓度的溶液仪器的选择、实验步骤、误差分析及相关计算。
本题难度:一般