1、填空题 有反应:4Zn+10 HNO3(极稀过量)→ 4Zn(NO3)2+ NH4NO3+3H2O
(1)反应中的还原剂是??,被还原的元素是??;
(2)反应中HNO3的作用是 (填序号)
a.氧化剂? b.催化剂? c.脱水剂? d.酸
(3) 若有0.1mol NH4NO3生成,转移电子 ?个。
(4)若有1mol HNO3参加反应,被还原的HNO3为?mol。
参考答案:(1)Zn, +5价N
(2)a d.? (3) 0.8NA ?(4)0.1mol
本题解析:略
本题难度:简单
2、填空题 (7分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4? B. H2O2 ? C. Cl2水? D. HNO3?
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去
Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH? B. NH3·H2O? C. CuO? D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:(7分)(1)B? CD (2)4? 3.3?可行
本题解析:(1)除杂的过程中不能引进新的杂质,H2O2为绿色氧化剂,产物为水;调节溶液pH不能引进新的杂质,用? CuO和Cu(OH)2即可。
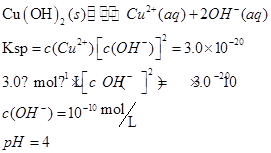
(2)
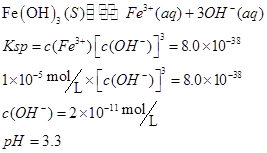
方案可行。
本题难度:一般
3、选择题 钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可用如下 化学方程式表示:①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑;②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3+7NaOH;③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH;下列说法不正确的是
[? ]
A.反应①②③均是氧化还原反应
B.反应②中的氧化剂是NaNO2
C.该生产过程会产生污染
D.整个反应中每有16. 8g Fe反应转移0.8mol电子
参考答案:A
本题解析:
本题难度:简单
4、选择题 对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
A.只有硫酸铜作氧化剂
B.SO42-既不是氧化产物又不是还原产物
C.被氧化与被还原的硫元素的质量比为3:7
D.当有1mol硫酸铜参加反应时,该反应转移1mol电子
参考答案:C
本题解析:本题考查氧化还原反应,有一定难度,学生明确反应中各元素化合价的变化是解答的关键,FeS2中Fe、S元素的化合价是解答的难度,并注意氧化还原反应中电子守恒来解答。在14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4反应中,CuSO4中Cu元素的化合价由+2降低为+1,在FeS2中Fe的化合价为+2,S的化合价为-1,在5个的FeS2中,一共有10个-1价的S,其中7个S的化合价由-1降低到-2,得到电子总数为7,加上Cu得到的14个电子,得到的电子总数为21个。显然另外3个S元素的化合价由-1升高到+6价,失去电子数也为21个,符合电子守恒。则Cu2S只是还原产物,当中的Cu与S都是被还原得到的。5molFeS2参加反应转移电子数为21mol,部分SO42-为氧化产物,FeS2既是作氧化剂,又做还原剂.
A、因硫酸铜中Cu元素的化合价降低,FeS2中部分S元素的化合价也降低,则硫酸铜、FeS2都是该反应中的氧化剂,故A错误;
B、因FeS2中部分S元素的化合价由-1升高到+6价,生成物中部分SO42-为氧化产物,故B错误;
C、由反应可知,10个S原子中,有3个S原子失去电子,7个S原子得到电子,即被氧化的硫与被还原的硫的质量比为3:7,故C正确;
D、由电子守恒可知,14mol硫酸铜参加反应时,转移21mol电子,当有1mol硫酸铜参加反应时,该反应转移1.5mol电子,故D错误;故选C.
本题难度:简单
5、选择题 实验室常利用以下反应制取少量氮气:NaNO2 + NH4Cl =" NaCl" + N2↑ + H2O关于该反应的下列说法不正确的是(?)
A.NaNO2的氧化性大于N2
B.每生成1mol N2,转移的电子数的物质的量为6mol
C.NH4Cl的还原性大于N2
D.氮元素既被氧化又被还原
参考答案:B
本题解析:分析NaNO2 + NH4Cl =" NaCl" + N2↑ + H2O,NaNO2是氧化剂,NH4Cl是还原剂,N2既是氧化产物,又是还原产物,所以,A.NaNO2的氧化性大于N2,正确;C.NH4Cl的还原性大于N2,正确;D.氮元素既被氧化又被还原,正确;B.每生成1mol N2,转移的电子数的物质的量为3mol,B错误。
本题难度:一般