1、选择题 NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。
(1)下列说法正确的是_________(填序号)。
A.解毒剂美蓝应该具有氧化性? B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原? D.中毒过程中血红蛋白显氧化性
(2)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O从上述反应推知________(填序号)。
A.氧化性:I2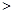 NaNO2?B.氧化性:NaNO2
NaNO2?B.氧化性:NaNO2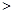 I2
I2
C.还原性:HI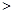 NO? D.还原性:I2
NO? D.还原性:I2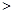 HI
HI
(3)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl。现供选用的物质有:①白酒?②碘化钾淀粉试纸?③淀粉?④白糖?⑤食醋,进行本实验时,可以选用的物质至少有__________(填序号)。
(4)某工厂的废液中含有2%~5%的NaNO2,直接排放会造成污染。下列试剂中:①NaCl②NH4Cl?③HNO3?④浓H2SO4,能使NaNO2转化为N2的是_______(填序号)。
参考答案:(1)C(2分)
(2)BC(2分,选对一个得1分,错选一个倒扣一分)
(3)②⑤(全对得2分)
(4)②(2分)
本题解析:(1)NaNO2使人中毒的原因是:NaNO2把Fe2+氧化为Fe3+,NaNO2发生了还原反应,血红蛋白显示了还原性,故B、D项错误;美蓝解毒时把Fe3+还原为Fe2+,美蓝具有还原性,所以A项错,C项正确。
(2)在同一氧化还原反应中,氧化性强弱顺序为:氧化剂>氧化产物;还原性强弱顺序为:还原剂>还原产物,所以BC项正确。
(3)根据(2)中化学反应,NaNO2在酸性条件下可将I?氧化为I2,所以②⑤即可鉴别NaNO2与NaCl。
(4)NaNO2转化为N2,NaNO2作氧化剂,需要加入还原剂,故选②NH4Cl。,,,
本题难度:一般
2、选择题 根据下表信息,下列叙述中正确的是
序号
| 氧化剂
| 还原剂
| 其他反应物
| 氧化产物
| 还原产物
|
①
| C12
| FeBr2
| ?
| ?
| Cl-
|
②
| KMnO4
| H2O2
| H2SO4
| O2
| Mn2+
|
③
| KClO3
| 浓盐酸
| ?
| Cl2
| C12
|
④
| KMnO4
| 浓盐酸
| ?
| Cl2
| Mn2+
|
? A、表中①组反应的氧化产物一定只有FeCl3
B、氧化性强弱比较:KMnO4>C12>Fe3+>Fe2+
C、还原性强弱比较:H2O2>Mn2+>Cl-
D、③反应中的浓盐酸即起还原剂作用又起酸的作用
参考答案:BD
本题解析:A选项中C12如果在过量情况下可以将+2价铁与-1价溴全部氧化。B选项中可以通过化学方程式中氧化剂氧化性大于氧化产物来进行判断,结果正确。C选项从第四个反应中可得出,还原剂还原性大于还原产物,所以有Cl->Mn2+。D选项正确。
本题难度:一般
3、填空题 将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+?HCl -?KCl+?MnCl2+?Cl2↑+?H2O
(2)上式反应中的还原剂是?,当还原剂失去1mol电子时,氧化产物的物质的量为?。
(3)a +b的最大值为?,a +b最小值为?。
(4)当 a +b =0.18时,残留固体的质量为?。
参考答案:(1)2? 16? 2? 2? 5? 8?(2)HCl? 0.5?(3)0.2? 0.16?(4) 12g.
本题解析:本题综合考查重要的化学基本概念——氧化还原反应的配平及计算,利用字母进行讨论分析、解决问题的能力,属于较高要求——综合应用层次。
(1)配平时注意不要漏掉等号。
(2)依据化合价变化情况,可较容易判断出还原剂是HCl,再弄清氧化产物是对应还原剂,即可得出结果。
(3)经对题目涉及的反应分析可知:a+b的最大值为只产生氯气时,即a=0时;则b=0.2,∴a+b="0.2?" a+b的最小值为产生氧气为最大量时,根据方程式可知产生氧气0.04mol,即a=0.04时;根据电子守恒知产生的二氧化锰还可氧化盐酸产生氯气的量:即b为=0.12,∴a+b=0.16
(4)当a+b=0.18时,4a+2(0.18-a)=0.4,a=0.02,
即:产生氧气:0.02mol×32g·mol-1=0.64g
由质量守恒可求出残留固体12g。
本题难度:简单
4、选择题 下列反应中氯元素被氧化的是
[? ]
A.5Cl2+I2+6H2O===10HCl+2HIO3
B.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl===MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O2 NaOH+Cl2↑+H2↑
NaOH+Cl2↑+H2↑
参考答案:D
本题解析:
本题难度:一般
5、选择题
A.Zn、Fe
B.Cu、Ag
C.Cu、Pt
D.Pt、Au
参考答案:A
本题解析:[解析]锌铁的活性排在氢前可以与盐酸反应
本题难度:简单