1、填空题 (8分)下表列出了①~⑥六种元素在元素周期表中的位置。
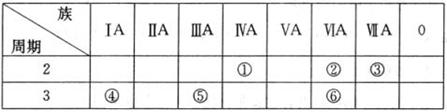
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是__ __(填写元素符号);
(2) ②、⑥两种元素的原子半径大小为:② ⑥(填“<”或“>”);;
(3) 元素①的原子结构示意图??;?
(4)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
______________?____________。
参考答案:(1)F (2)<(3)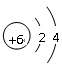 (4)Al(OH)3+OH-=AlO2-+2H2O
(4)Al(OH)3+OH-=AlO2-+2H2O
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~⑥分别为C、O、F、Na、Al、S。
(1)同周期元素自左向右非金属性逐渐减弱,所以非金属性最强的是F。
(2)同主族元素自上而下原子半径逐渐增大,所以S的原子半径大于O的原子半径。
(3)C的原子序数是6,所以原子结构示意图为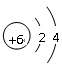 。
。
(4)④、⑤两种元素的最高价氧化物对应的水化物分别是氢氧化钠和氢氧化铝,氢氧化铝是两性氢氧化物能溶于强碱,方程式为Al(OH)3+OH-=AlO2-+2H2O。
本题难度:一般
2、选择题 短周期元素X和Y中,X原子的最外层电子数是内层电子总数的一半,Y元素在该元素的前一周期,Y2-离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是?
A.Z是一种酸酐
B.Z是一种碱性氧化物
C.Z的分子式一定是X2Y5
D.Z中含有离子键
参考答案:A
本题解析:略
本题难度:简单
3、填空题 物质结构的多样性让人类使用的材料精彩纷呈。
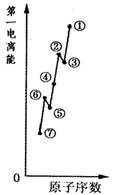
(1)如图是原子序数相连的七种短周期元素第一电离能示意图。其中硼B元素是?(填图中元素代号)。
(2)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为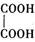 ,草酸钠晶体中存在?(填图中元素代号)。
,草酸钠晶体中存在?(填图中元素代号)。
A金属键;B非极性键;C键;D范德华力;E氢键;F离子键
(3)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。锆石与钛同族的第五周期元素,锆原子的价电子排布式为?。
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为?;若碳酸中的碳氧原子都在同一平面,则碳原子的杂化类型是?。
(5)PtCl4和氨水反应可获得PtCl4? 4NH3,PtCl4?4NH3 是一种配合物。100mL0.1mol?L-1PtCl4?4NH3 溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀。该配合物溶于水的电离方程式为?。
参考答案:
(1)⑤(2分)
(2)BCF(2分)
(3)4d25s2? (2分)
(4)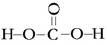 (2分)?sp2(2分)
(2分)?sp2(2分)
(5)〔PtCl2(NH3)4〕Cl2 = 〔PtCl2(NH3)4〕2+ + 2Cl- (3分)
本题解析:(1)同周期元素的第一电离能从左到右依次增大趋势,但第ⅡA、ⅤA族元素的原子最外层电子呈全满和半满的相对稳定结构,能量较低,第一电离能较大,故②、⑥分别为Be、N,⑤为B元素;(2)草酸钠为离子晶体,含有离子键、草酸根离子中含有非极性键(碳碳键)、极性键(碳氢键、碳氧键);(3)同族元素原子价电子排布相同;(4)根据题意含有2个羟基,还应含有羰基,故结构式为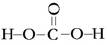 ;分子空间结构为平面结构故碳原子为sp2;
;分子空间结构为平面结构故碳原子为sp2;
(5)n(Cl-)= n(AgCl)=2.87÷143.5=0.02mol
n(PtCl4?4NH3)= 0.1×0.1=0.01mol,所以1mol能电离出2个氯离子,即外界有2个氯离子,化学式为PtCl2(NH3)4〕Cl2,电离方程式为〔PtCl2(NH3)4〕Cl2 = 〔PtCl2(NH3)4〕2+ + 2Cl-。
本题难度:一般
4、填空题 (6分)N3-称为叠氮离子,1个N3-中共含有?个电子,与N3-离子有相同电子数和原子数的分子有(写出2种)?。
参考答案:22?(2分)? CO2、N2O(4分)
本题解析:略
本题难度:简单
5、选择题 元素R核电荷数为16,原子的质量数32,则R离子应包含电子、质子、中子分别为:
A.16、16、16
B.18、16、16
C.18、18、16
D.16、16、18
参考答案:B
本题解析:略
本题难度:简单