1、选择题 用已准确称量过的氯化钠固体配制1.00mol?L-1的氯化钠溶液0.5L,要用到的仪器是( )
①500mL容量瓶②试管③烧瓶④胶头滴管⑤烧杯 ⑥玻璃棒⑦托盘天平⑧药匙.
A.①④⑤⑥⑦⑧
B.①②④⑤
C.①④⑤⑥
D.全部
参考答案:操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,冷却后转移到500ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管,由于氯化钠已经称量完毕,故需要烧杯、玻璃棒、500ml容量瓶、胶头滴管,即①④⑤⑥,
故选C.
本题解析:
本题难度:简单
2、计算题 (10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少? (2)剩余HCl的物质的量为多少?
参考答案:4.48L;3.2mol
本题解析:
试题解析:8.7MnO2的物质的量=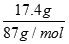 =0.2mol,则:
=0.2mol,则:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4 1
0.2mol n(HCl) n(Cl2)
n(Cl2)=n(MnO2)==0.2mol,V(Cl2)=22.4L/mol×0.2mol=4.48L;(2)原溶液中氯化氢的物质的量= =4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
=4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
考点:化学方程式的有关计算
本题难度:一般
3、选择题 0.2 mol某元素的单质直接与Cl2化合后,生成物质质量增加了14.2 g,这种元素的化合价是(? )
A.+1
B.+2
C.+3
D.+5
参考答案:B
本题解析:14.2 g Cl2的物质的量为: ="0.2" mol,故该元素M与Cl2反应的计量数比为1∶1,即M+Cl2====MCl2,故MCl2中M为+2价。
="0.2" mol,故该元素M与Cl2反应的计量数比为1∶1,即M+Cl2====MCl2,故MCl2中M为+2价。
本题难度:简单
4、选择题 某混合溶液中含有0.2molNa+,0.25molMg2+,0.4Cl-,则SO42-的物质的量为
A.0.1mol
B.0.3mol
C.0.5mol
D.0.15mol
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列说法正确的是( )
A.N2的摩尔质量为28 g
B.17 g NH3的物质的量是1 mol
C.18 g H2O在标准状况下的体积是22.4 L
D.将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L