1、选择题 下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=" -216" KJ/mol,反应物总能量小于生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E2=E1
C.101KPa时,2H2(g)+O2(g) =2H2O(l) △H=" -517.6" KJ/mol,若生成气态水,△H小于-517.6 KJ/mol
D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
参考答案:D
本题解析:A.反应放热,说明反应物总能量大于生成物总能量,A错误。
B.1mol氢分子含有2mol氢原子,故其具有的能量为2mol氢原子的总能量,E2=2E1,B错误。
C.液态水转化为气态水要吸热,故生成气态水放出的热量要少,但△H要大,C错误。
D.利用太阳能等清洁能源代替化石燃料,利于节约资源、保护环境,正确。
故选D
本题难度:一般
2、选择题 已知碳、一氧化碳、晶体硅的燃烧热分别是△H =-393.5kJ/mol、△H ="-283" kJ/mol和△H ="-989" kJ/mol,则工业冶炼晶体硅反应2C(s)+SiO2(s)=" Si" (s)+2 CO(g) △H =
A.+768 kJ/mol
B.-768 kJ/mol
C.+2342 kJ/mol
D.-2342 kJ/mol
参考答案:A
本题解析:根据碳、一氧化碳、晶体硅的燃烧热分别是△H =-393.5kJ/mol、△H ="-283" kJ/mol和△H ="-989" kJ/mol,可分别得到热化学方程式:①C(s)+O2(g)=CO2(g) △H =-393.5kJ?mol?1, ②CO(g)+1/2O2(g)=CO2(g) △H ="-283" kJ?mol?1,③Si(s)+ +O2(g)=SiO2(g) △H ="-989" kJ/mol,根据盖世定律,反应2C(s)+SiO2(s)=" Si" (s)+2 CO(g)等效于①×2—②×2—③,所以△H =-393.5kJ/mol×2+283 kJ/mol×2+989 kJ/mol="+768" kJ/mol,故A项正确。
本题难度:一般
3、选择题 已知:①1mol?H2分子中化学键断裂时需要吸收436kJ的能量
②1mol?Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol?HCl分子时释放431kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
参考答案:A.热化学方程式应标出反应热的数值,故A错误;
B.H2(g)+Cl2(g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431?kJ?mol-1=-183kJ?mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ/mol,故B错误;
C.反应热=生成物的键能减反应物的键能=436kJ?mol-1+243kJ?mol-1-2×431?kJ?mol-1=-183kJ?mol-1,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ/mol,故C正确;
D.当生成1mol氯化氢气体时,放出的热量是原来的一半,△H=-91.5kJ/mol,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
A.H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g)△H=+571.6 kJ/mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s)△H<0
D.已知:298K时,N2(g)+3H2(g) 2NH3(g)△H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入1/2 mol N2和3/2 mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g)△H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入1/2 mol N2和3/2 mol H2,达到平衡时放出46.0 kJ的热量
参考答案:C
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,氢气的稳定氧化物是液态水,A不正确。反应物的总能量低于生成物的总能量时,该反应为吸热反应,反之是放热反应,B不正确。能量越低,越稳定,由此石墨的能量低于金刚石的,所以金刚石生成石墨的反应是放热反应,C正确。氨气的合成是可逆反应,1/2 mol N2和3/2 mol H2不可能生成1mol氨气,所以放出的热量低于46.0 kJ,D不正确。答案选C。
本题难度:一般
5、填空题 根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中
进行反应和测定中和反应的反应热。
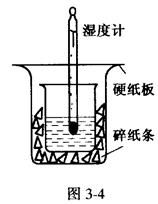
(1)图3-4装置缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是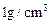 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________
(填“相同”或“不相同”)。
参考答案:(1)?环形玻璃搅拌棒?大小烧杯口没有齐平、??减小??、
(2)减小 ?
(3)--4C(t-18)KJ∕mol
(4)?增多??、相同
本题解析:略
本题难度:简单