1、填空题 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
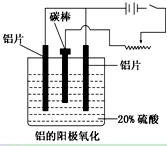
2Al2O3? ?4Al+3O2↑
?4Al+3O2↑
加入冰晶石的作用:________________________________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________________,下列可作阴极材料的是__________。
A.铝材?B.石墨? C.铅板?D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_____________________________________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(5)下列说法正确的是__________________。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
参考答案:(1)主要是降低Al2O3的熔化温度
(2)Al-3e-=Al3+? D
(3)2Al-6e-+3H2O=Al2O3+6H+
(4)铝阳极表面不断生成氧化物,电阻增大,为了保持稳定的电流,需要不断增大电压
(5)BD
本题解析:(1)由于Al2O3熔点很高,加入冰晶石可以降低Al2O3的熔点,作助熔剂。
(2)在电解池中阳极发生氧化反应,金属失去电子,电极反应式为Al-3e-=Al3+;电解精炼铝应以纯铝作阴极材料,故D项正确。
(3)根据阳极发生氧化反应可以得到电极反应式为:2Al+3H2O-6e-=Al2O3+6H+。
(4)铝阳极生成氧化物薄膜后会使电阻增大,为了保持稳定的电流,需要随电阻增大而不断增大电压。
(5)阳极氧化应用的是电解原理,A项错误;由于氧化物的生成可以增强铝表面的绝缘性,B项正确;铝的阳极氧化可以提高铝及铝合金的耐腐蚀性,但耐磨性不下降,C项错误;氧化铝具有不同的晶型,其中的δ-Al2O3具有多孔性、强吸附性和催化活性,可做吸附剂和催化剂,D项正确。
本题难度:一般
2、选择题 用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
?
| 阳极
| 阴极
| 溶液甲
| 物质乙
|
A.
| Pt
| Pt
| NaOH
| NaOH固体
|
B.
| Pt
| Pt
| H2SO4
| H2O
|
C.
| C
| Fe
| NaCl
| 盐酸
|
D.
| 粗铜
| 精铜
| CuSO4
| Cu(OH)2
参考答案:B
本题解析:
【错解分析】本题误区是多选了选项C,从表面上看,电解氯化钠水溶液,阴极出氢气;阳极出氯气。两极产生的气体物质的量相等,转化为氯化氢,用相当量的盐酸补充,应该能恢复氯化钠溶液原来的浓度。但是这里忽略了盐酸溶液中的水,氯化钠溶液的浓度必然变稀,不可恢复。若改为通入氯化氢气体,应是正确选项。
【正解】选项B中电解硫酸,阴极出氢气;阳极出氧气,实质是电解水。因此补充一些水,可以恢复硫酸溶液原来的浓度。
本题难度:简单
3、选择题 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是
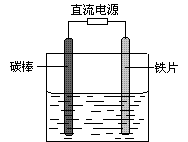
A.碳棒接直流电源的负极
B.碳棒上发生还原反应
C.铁片上的电极反应式为2Cl――2e- = Cl2↑
D.铁片附近出现的浑浊物是Mg(OH)2
参考答案:D
本题解析:因为在碳棒和铁片表面均有气体生成,且铁片附近出现浑浊现象,则说明溶液中少量的Mg2+与反应生成的OH-发生反应,则放出气体的反应式为2Cl――2e- = Cl2↑,2H2O+2e-═H2↑+2OH-。A、碳棒上发生的反应为2Cl――2e- = Cl2↑,接电源正极,故A错误;B、碳棒上发生的化学反应化合价升高是氧化反应,故B错误;C、铁片上的电极反应式为2H2O+2e-═H2↑+2OH-,故C错误;D、铁片附近的浑浊物为溶液中的Mg2+与OH-反应生成的沉淀,故D正确
本题难度:一般
4、选择题 用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是(?)
A.NaCl
B.Na2CO3
C.CuSO4
D.K2S
参考答案:B
本题解析:加适量水能使溶液恢复到电解前的浓度,则电解的实质是电解水,故选项B符合。
本题难度:一般
5、填空题 (8分)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
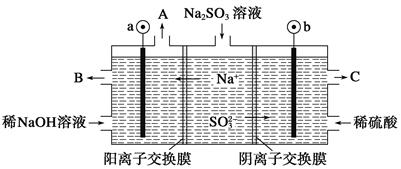
(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
(2)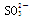 放电的电极反应式为________ ____。 放电的电极反应式为________ ____。
(3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因____ ____。
参考答案:(1)负 硫酸;(2)  ;(3)H2O ;(3)H2O H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强 H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
本题解析:(1)根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,(2)SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+;(3)在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强;故答案为:(1)负 ;硫酸;(2)  ;(3)H2O ;(3)H2O H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强 H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
考点:电解原理
本题难度:一般
|