1、选择题 将锌片和铜片用导线连接置于同一稀硫酸中,下列叙述正确的是
A.锌片是正极
B.电流方向从锌片流向铜片
C.氢气在锌片上产生
D.若锌片、铜片同时有气泡冒出,则说明锌片不纯
参考答案:D
本题解析:考查原电池
相对活泼的锌极为负极,失电子,电子经导线流向正极铜,电流方向是从铜片至锌片,氢离子在正极得电子生成氢气,排除ABC,答案为D:若锌片不纯,则可在锌片上形成微电池,也可产生气泡
本题难度:一般
2、选择题 查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2+4e—+2H2O=4OH—
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O
参考答案:D
本题解析:A.根据同种电荷相互排斥,异种电荷相互吸引的原则,在电池内部H+由负电荷较多的正极移动。正确。B.通入氧气的电极为正极。在酸性条件下在正极发生的电极反应式为:O2+4e—+4H+ = 2H2O.错误。C.乙醇在负极发生反应,电子经过外电路流向正极。错误。D.根据题意及负极的电极式可知该电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O。正确。
本题难度:一般
3、选择题 下图装置中发生反应的离子方程式为:Zn+2H+→Zn2++H2↑,下列说法错误的是
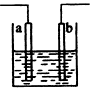
[? ]
A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
参考答案:A
本题解析:
本题难度:一般
4、选择题 研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:? 5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”?电池在海水中放电时的有关说法正确的是
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移1 mol电子
C.Na+不断向“水”电池的正极移动
D.AgCl是还原产物
参考答案:C
本题解析:由电池总反应可知银失去电子被氧化得氧化产物,即银做负极,产物AgCl是氧化产物,选项A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,选项C正确;化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1 mol Na2Mn5O10转移电子的物质的量为(4-18/5)×5=2mol,因此选项B不正确,答案选C。
本题难度:一般
5、选择题 下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:
OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
参考答案:C
本题解析:A、合成氨生产过程中将NH3液化分离,不能加快正反应速率,错误;B、Ba(OH)2与H2SO4反应生成BaSO4沉淀和H2O,该反应的反应热不是中和热,错误;C、电解精炼铜,阳极除了Cu失电子,还有比铜活泼的锌、镍、铁失电子,正确;D、该反应气体的系数不变,增大平衡体系的压强,平衡不移动,与勒夏特列原理无关,错误。
本题难度:一般