1、选择题 甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ/mol
②CO(g)+2H2( g)=CH3OH(l) △H=-90.5 kJ/mol
下列说法不正确的是
[? ]
A.CO(g)+2H2(g)=CH3OH(g) △H>-90.5 kJ/mol
B.在甲醇燃料电池中,甲醇所在的电极为正极
C. CH4(g)+1/2O2(g)=CH3OH(l) △H=-126kJ.mol-1
D.反应①中的能量变化如下图所示
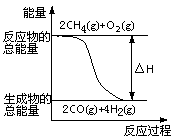
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列实验能达到预期目的的是
编号
| 实验内容
| 实验目的
|
A
| 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。
| 可以证明H2C2O4浓度越大反应速率越快。
|
B
| 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。
| 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3
|
C
| 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。
| 证明了非金属性S>C
|
D
| 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。
| 可以证明Na2CO3溶液中存在水解平衡。
|
?
参考答案:D
本题解析:A、两只试管中草酸的浓度几乎是相同的,所以不能证明H2C2O4浓度越大反应速率越快,A不正确;B、由于氢氧化钠在和氯化镁溶液反应时氢氧化钠过量,所以再加入氯化铁时一定产生红褐色氢氧化铁沉淀,所以不能证明在相同温度下溶解度Mg(OH)2>Fe(OH)3,B不正确;S元素的最高价是+6价,因此应该测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,如果后者较大可以证明非金属性S>C,C不正确;D、向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅,这说明溶液中OH-浓度降低,这是由于碳酸钠与氯化钡反应生成了碳酸钡沉淀,从而抑制了CO32-的水解,溶液的碱性降低,D正确,答案选D。
本题难度:一般
3、选择题 如下图所示,a、b是两根石墨棒,下列叙述错误的是?
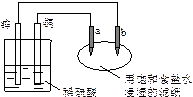
A.往滤纸上滴加酚酞试液,a极附近颜色变红
B.锌电极上的反应:Zn-2e→Zn2+
C.稀硫酸中硫酸根离子的物质的量不变
D.a是阳极,发生氧化反应
参考答案:A
本题解析:略
本题难度:简单
4、选择题 对于原电池的电极名称,叙述错误的是( )
A.发生氧化反应的一极为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流流出的一极为正极