1、填空题 依据氧化还原反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题:
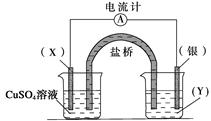
(1)电极X的材料是?,电解质溶液Y是?;
(2)银电极为电池的?极,发生的电极反应为?; X电极上发生的电极反应为?。
(3)外电路中的电子是从?电极流向?电极。
参考答案:(1)Cu? AgNO3溶液
(2)正? Ag++e-==Ag? Cu-2e-== Cu2+? (3) X(Cu) Ag
本题解析:(1)根据电解质溶液中的阳离子与电极材料是同种金属的特点,可推知X是Cu,电解质溶液Y是AgNO3溶液。(2)由于活动性Cu>Ag,结合原电池反应的原理可知:银电极为电池的正极,发生的反应为Ag++e-==Ag;Cu电极上发生的电极反应为:Cu-2e-== Cu2+。(3)外电路中的电子是从负极Cu电极流向正极Ag电极。
本题难度:一般
2、选择题 磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
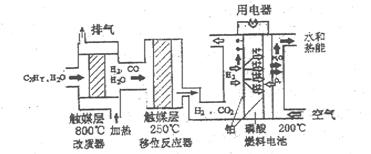
下列说法不正确的是?(?)
?
A.在改质器中主要发生的反应为CXHy+XH2O XCO+(X+Y/2)H2
XCO+(X+Y/2)H2
B.移位反应器中CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 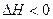 。温度越高,CO转化率越大
。温度越高,CO转化率越大
C.负极排出的气体主要是CO2
D.该电池正极的电极反应为O2+4H++4e-=2H2O
参考答案:B
本题解析:略
本题难度:简单
3、选择题 归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa? b.NaHCO3?c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)="2" B (g) △H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ.mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
A.全部
B.③④⑤⑥
C.②④⑤⑥
D.①②④⑤
参考答案:B
本题解析:加水稀释后,酸中的c(H+)减小,但溶液中的c(OH-)增大,①错;pH=2的酸c(H+)=10-2mol·L-1,pH=1的酸c(H+)=10-1mol·L-1,c(H+)之比为1:10,②错;CH3COONa、NaHCO3溶液水解后显碱性,但HCO3-的水解程度大于CH3COO-,因此pH相等时NaHCO3溶液浓度小,NaOH是强碱,相同pH时浓度最小,③正确;该反应是熵增的反应,不能自发进行则△H一定大于0,④正确;醋酸的电离平衡常数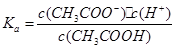 ,醋酸跟的水解常数
,醋酸跟的水解常数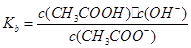 ,则Ka·Kb= c(H+)·c(OH-)=Kw,⑤正确;正反应的活化能为反应物断裂化学键吸收的能量,逆反应的活化能为生成物形成化学键释放的能量,故反应热正反应活化能减去逆反应活化能,⑥正确。
,则Ka·Kb= c(H+)·c(OH-)=Kw,⑤正确;正反应的活化能为反应物断裂化学键吸收的能量,逆反应的活化能为生成物形成化学键释放的能量,故反应热正反应活化能减去逆反应活化能,⑥正确。
本题难度:一般
4、选择题 理论上不能设计原电池的化学反应是
[? ]
A.CH4 + 2O2 → CO2 + 2H2O
B.HNO3 + NaOH = NaNO3 + H2O
C.2H2 + O2 = 2H2O
D.2FeCl3 + Fe = 3FeCl2
参考答案:B
本题解析:
本题难度:简单
5、选择题 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 (? )
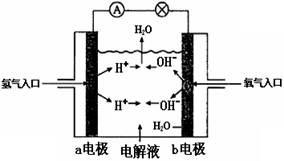
A.b电极是正极
B.a电极的电极反应为: O2 +2 H2O+ 4e- = 4OH-
C.氢氧燃料电池中的电子是从a电极经外电路流向b电极
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
参考答案:B
本题解析:氢气在反应中失去电子,所以a电极负极,b电极通入氧气,得到电子,是正极,因此选项B不正确,其余都是正确的,答案选B。
本题难度:一般