1、选择题 如图所示,将铁棒和石墨棒插入饱和食盐水中。下列说法正确的是
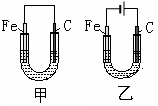
A.甲中铁被保护不会腐蚀
B.甲中正极反应式为4OH--4e- = 2H2O+O2?
C.乙中铁电极上发生氧化反应
D.乙中石墨电极附近滴几滴碘化钾淀粉溶液变蓝色
参考答案:D
本题解析:A.甲是原电池,铁作负极被腐蚀。碳作正极。错误。B. 甲中正极反应式为2H2O+4e-+O2=4OH-.错误。C.乙装置是电解池。Fe作阴极,阴极上发生还原反应。错误。D.乙中石墨电极为阳极。2Cl-—2e-=Cl2↑.Cl2+2I-=2Cl-+I2. I2遇淀粉溶液变蓝色。正确。
本题难度:一般
2、计算题 如图A、B两个装置,回答下列问题:
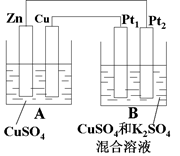
(1)A为_________池,Pt1为______极。
(2)当电路中通过0.02mol电子时,A溶液质量变化为_______________g;
同时B中收集到标准状况下的气体224mL,则反应前B池中原混合溶液中Cu2+的浓度是__?______(设B中原混合液的体积为200mL)。
参考答案:(1)原; 阳(各1分) (2)0.01(2分)?(3)0.025mol/L (2分)
本题解析:(1)锌能和硫酸铜发生置换反应,所以A是原电池。其中锌是负极,铜是正极。B是电解池,则Pt1与电源的正极相连,做阳极,Pt2为阴极。
(2)锌电极的电极反应式是Zn-2e-=Zn2+,则当电路中通过0.02mol电子时,消耗锌的质量是0.65g。而铜电极表明生成0.64g铜,所以A中溶液增加0.65g-0.64g=0.01g。B中阳极始终是OH-放电生成氧气,电极反应式是4OH--4e-=2H2O+O2↑,根据电子得失守恒可知,生成氧气的体积是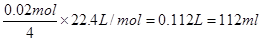 。但B中收集到标准状况下的气体224mL,这说明B中还有氢气生成,其中氢气的体积是224ml-112ml=112ml,物质的量是0.005mol。由于B中阴极首先是铜离子放电,然后是氢离子放电,电极反应式分别是Cu2++2e-=Cu、2H++2e-=H2↑,所以根据电子的得失守恒可知,析出的铜是
。但B中收集到标准状况下的气体224mL,这说明B中还有氢气生成,其中氢气的体积是224ml-112ml=112ml,物质的量是0.005mol。由于B中阴极首先是铜离子放电,然后是氢离子放电,电极反应式分别是Cu2++2e-=Cu、2H++2e-=H2↑,所以根据电子的得失守恒可知,析出的铜是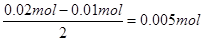 ,所以原溶液中Cu2+的浓度是0.005mol÷0.2L=0.025mol/L。
,所以原溶液中Cu2+的浓度是0.005mol÷0.2L=0.025mol/L。
点评:该题是中等难度的试题,也是高考中的常见考点。试题基础性强,侧重对能力的培养和解题方法的训练与指导,有利于培养学生的逻辑思维能力和应试能力。该题的关键是利用好电子得失守恒,其次要熟练掌握离子的放电顺序。
本题难度:一般
3、选择题 下图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
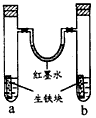
[? ]
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe -2e-= Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
参考答案:B
本题解析:
本题难度:一般
4、选择题 在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )。
A.锌作阳极,铁制品作阴极,溶液中含有锌离子
B.铂作阴极,铁制品作阳极,溶液中含有锌离子
C.铁作阳极,铁制品作阴极,溶液中含有亚铁离子
D.锌作阴极,铁制品作阳极,溶液中含有亚铁离子
参考答案:A
本题解析:根据电镀原理,应用镀层金属作阳极,镀件作阴极,含有镀层金属阳离子的电解质溶液作电镀液,因此选A。
本题难度:一般
5、选择题 如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O=2Ag+Zn(OH)2。下列有关说法正确的是( )。
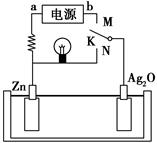
A.放电时的负极反应和充电时的阴极反应属于可逆反应
B.在电池放电过程中溶液的pH增大
C.K与N相接时,能量由化学能转化为电能,溶液中的OH-向正极区移动
D.K与M连接时,所用电源的a极为负极,阳极附近溶液的pH逐渐增大
参考答案:B
本题解析:由于二次电池在放电和充电时的条件不同,因此两极反应不可能互为可逆反应,A错。分析电池反应可知,该电池的介质应是碱性的,在放电过程中水的量在减少,因此溶液的碱性增强,B正确。当K与N相接时,相当于原电池,能量由化学能转化为电能,溶液中的阴离子应向负极区移动,C错。当K与M连接时,相当于电解装置,电极反应式分别为Zn(OH)2+2e-=Zn+2OH-,2Ag+2OH--2e-=Ag2O+H2O,因此a极为负极,阳极附近溶液的pH减小,D错。
本题难度:一般