1、选择题 要增大?Zn?和稀?H2SO4间置换反应的速率,下列措施正确的是( )
A.使用高纯度的锌粒
B.使用浓H2SO4
C.使用小颗粒的锌粒
D.使用浓HNO3
参考答案:A、使用高纯度的锌粒,不会改变反应速率,故A错误;
B、锌和浓硫酸之间发生的不是置换反应,故B错误;
C、增大固体的表面积可以加快化学反应速率,故C正确;
D、锌和浓硝酸之间发生的不是置换反应,故D错误.
故选C.
本题解析:
本题难度:一般
2、选择题 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是(? )
①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
A.①③④⑤
B.①②④⑤
C.①②③④
D.①②④
参考答案:B
本题解析:增大盐酸与锌粒的反应速率,可通过外界条件对化学反应速率的影响来考虑,可增大氢离子浓度、升高温度,增大固体的表面积或通过原电池反应等因素来实现。
①温度升高,反应速率增大,故①正确;②改用100mL3mol?L-1盐酸,反应物的浓度增大,反应速率增大,故②正确;③多用300mL 1mol/L盐酸,反应物的量增多,但浓度不变,反应速率不变,故③错误;④用等量锌粉代替锌粒,固体的表面积增大,反应速率增大,因此选项④正确;⑤滴入少量CuSO4溶液,锌可以置换出铜,从而构成铜锌原电池,加快反应速率,⑤正确,答案选B。
本题难度:一般
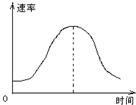
3、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示.在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度.影响反应速率的因素是( )
A.①④
B.③④
C.①②③
D.②③