|
|
|
高考化学知识点归纳《离子方程式的书写及正误判断》高频考点巩固(2019年模拟版)(三)
2020-07-08 00:49:53
【 大 中 小】
|
1、填空题 (13分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题:
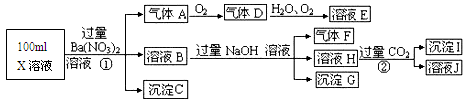
(1)气体F为____________。
(2)上述离子中,溶液X中除H+外还肯定含有的离子是_______,不能确定是否含有的离子是____。
(3)写出生成A的离子方程式:_________________。
(4)通常可以利用KClO在碱性条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式__________________。
2、选择题 下列反应的离子方程式书写正确的是
A.向稀硫酸中加入氢氧化钡溶液:OH-+ H+ ="=" H2O
B.铜与稀硝酸反应:Cu +2NO3- + 4H+===Cu2+ + 2NO2↑+ 2H2O
C.向氯化铝溶液中加入过量氨水:Al3+ + 3NH3?H2O ===Al(OH)3↓+ 3NH4+
D.向氯化铁溶液中加入过量铜:Fe3+ +Cu ===Fe +Cu2+
|
3、选择题 能正确表示下列反应的离子反应方程式为
A.大理石溶于醋酸溶液: CaCO3 + 2H+==Ca2+ + CO2↑+ H2O
B.向FeBr2溶液中通入足量氯气:2Fe2+ + 4Br- + 3Cl2===2Fe3+ + 2Br2 + 6Cl-
C.NH4HCO3溶于过量的NaOH溶液中:HCO3- + OH-===CO32- + H2O
D.向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
|
2Al3+ + 3SO42- + 3Ba2+ + 6OH-=== 2Al(OH)3↓ + 3BaSO4↓
4、选择题 下表中评价合理的是

5、填空题 (15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
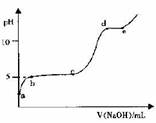
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。

