|
|
|
高考化学知识点归纳《离子方程式的书写及正误判断》高频考点巩固(2019年模拟版)(五)
2020-07-08 00:49:53
【 大 中 小】
|
1、填空题 Ⅰ.将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,已知A组溶液显酸性,且每组中均含两种阳离子和两种阴离子。
A组: 。
B组:
Ⅱ.写出下列过程反应的离子方程式:
(1)向澄清石灰水中滴加少量NaHCO3溶液: 。
(2)向饱和Na2CO3溶液中通入足量CO2气体: 。
(3)向明矾溶液中,逐滴加入Ba(OH)2溶液至SO42-沉淀完全: 。
(4)用1 L 1.0 mol·L-1的NaOH溶液吸收0.7molCO2气体: 。
2、选择题 下列化学反应表示正确的是
A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO-
B.用惰性电极电解饱和NaCl溶液:2H++2Cl-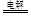 Cl2↑+H2↑ Cl2↑+H2↑
C.用石墨作电极电解CuSO4溶液:2Cu2++2H2O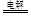 2Cu+O2↑+4H+ 2Cu+O2↑+4H+
D.钢铁发生吸氧腐蚀时负极反应为:Fe - 3e- = Fe3+
|
3、选择题 下列反应的离子方程式不正确的是
A.碳酸氢钙溶液加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++OH-=NH3·H2O
C.在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色:5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4— + 2H2O
D.等体积同浓度NaHSO4、Ba(OH)2两溶液混合:H++SO42—+Ba2++OH—=BaSO4↓+H2O
|
4、填空题 (12分)钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
5、选择题 下列离子方程式书写正确的是
A.氯气通入水中H2O+ Cl2 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.氯化铁溶液中加入铁粉2Fe3+ + Fe 3Fe2+
3Fe2+
C.碳酸钙加入盐酸中 C032-+2H+=CO2↑+H2O
D.铜片加入稀硝酸中Cu + 2 H+ = Cu2++H2↑
 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO- 3Fe2+
3Fe2+