1、填空题 (9分)(1)按下图装置进行实验,可观察到的现象有: 。其中Zn极发生 反应(填“氧化”或“还原”),写出电极反应式 。
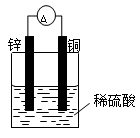
(2)有同学把Zn粒放入盛有稀盐酸的试管中,加入几滴CuCl2 溶液,气泡放出的速率加快。其原因是 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为________,当正极消耗5.6 L(标准状况)气体时,外电路转移的电子数为________。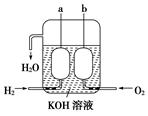
参考答案:(9分)(1)灵敏电流表的指针发生了偏转,锌片溶解,铜片上有气泡产生(2分)。
氧化(1分) Zn — 2e- ="=" Zn2+ (2分)
(2)锌-铜稀盐酸形成原电池,加快锌的氧化 ( 2分)
(3)H2 6.02×1023 (各1分,共2分)
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子。
(2)锌能置换出铜,从而构成铜锌原电池,锌作负极,加快反应速率。
(3)氢气失去电子,所以氢气在负极通入,氧气在正极通入。因为1mol氧气得到4mol电子,所以转移的电子是5.6L÷22.4L/mol×4=1.0mol。
本题难度:一般
2、选择题 利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是

A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法
B.若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
C.若X为碳棒,开关K置于B处,在铁棒附近滴入铁氰化钾溶液可看到溶液变血红色
D.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红
参考答案:D
本题解析:A、若X为锌棒,开关K置于A处,则此时构成电解池,铁作阴极可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法,A不正确;B、若X为铜棒,开关K置于A处,则此时构成电解池,铜电极是阳极,失去电子,铁是阴极,装置中不可能发生的总反应为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,B不正确;C、若X为碳棒,开关K置于B处,则此时构成原电池。铁是负极,失去电子生成亚铁离子,因此在铁棒附近滴入铁氰化钾溶液看不到溶液变血红色,C不正确;D、若X为碳棒,开关K置于B处,则此时构成原电池。铁是负极,碳棒是正极,溶液中的氧气得到电子生成氢氧根离子,因此向食盐水中滴入酚酞溶液可看到碳棒附近先变红,D正确,答案选D。
2NaOH+Cl2↑+H2↑,B不正确;C、若X为碳棒,开关K置于B处,则此时构成原电池。铁是负极,失去电子生成亚铁离子,因此在铁棒附近滴入铁氰化钾溶液看不到溶液变血红色,C不正确;D、若X为碳棒,开关K置于B处,则此时构成原电池。铁是负极,碳棒是正极,溶液中的氧气得到电子生成氢氧根离子,因此向食盐水中滴入酚酞溶液可看到碳棒附近先变红,D正确,答案选D。
本题难度:一般
3、填空题 (7分)
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。 正极 ,负极 ,电解质溶液 ,电极反应式 、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A 称量的是长期暴露在空气中的NaOH
B 容量瓶不干燥
C 将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D 混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切
参考答案:(1)正极:C或Cu;负极:Zn ;电解质溶液:FeCl3溶液;(每空1分)
负极反应式:Zn-2e-=Zn2+;正极反应式:2Fe3++2e-=2Fe3+(每空1分)
(2) (2分)CE
本题解析:(1)由反应Zn+2FeCl3
本题难度:一般
4、简答题 请从如图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气.

(1)A极发生的电极反应式是______B极发生的电极反应式是______
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接______、______接______;B接______、______接______.
(3)证明产物中有Cl2的实验现象是______.
(4)已知电解后测得产生的H2的体积为44.8mL(已经折算成标准状况),电解后溶液的体积为50mL,此时溶液中NaOH的物质的量浓度为______.
(5)有一和电解饱和食盐水能量转换相反的装置中,一极通入甲烷,另一极通入氧气,电解质溶液为KOH溶液,负极的反应式为______正极的反应式为______.
参考答案:(1)电解饱和食盐水获得氯气时,A极是活泼金属电极,应为阴极,阴极上是氢离子得电子,
反应式为:2H++2e-=H2↑,B极是阳极,阳极是氯离子失电子的过程,反应式是:2Cl--2e-=Cl2↑,
故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
(2)测定产生的氢气的体积用排水量气法,导管是短进长出,所以A接G,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C,故答案为:G、F、H、D、E、C;
(3)氯气可以将碘化钾中的碘置换出来,生成的碘单质可使使湿润的淀粉碘化钾试纸变蓝,所以证明产物中有Cl2的实验现象是湿润的淀粉碘化钾试纸变蓝,故答案为:湿润的淀粉碘化钾试纸变蓝;
(4)根据电解饱和食盐水的电解原理方程式:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,当产生的H2的体积为44.8mL0.002mol时,生成氢氧化钠的物质的量为0.004mol,所以溶液中NaOH的物质的量浓度=0.004mol0.05L=0.08mol/L,
故答案为:0.08mol/L;
(5)在甲烷燃料电池中,负极上失电子的是燃料甲烷,在碱性环境下电极反应为:CH4-8e-+10OH-=CO32-+7H2O,正极上得电子的是氧气,在碱性环境下电极反应为:2O2+8e-+4?H2O=8OH-,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;2O2+8e-+4?H2O=8OH-.
本题解析:
本题难度:一般
5、选择题 下列各变化中属于原电池反应的是
[? ]
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
参考答案:B
本题解析:
本题难度:简单