1、简答题 组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的基态原子核外电子排布式是______,其第一电离能比O的______(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置______.
(2)CO2是一种温室气体,它的电子式为______,将其转变其他化工原料,必须破坏的化学键属于______(填“极性”或“非极性”)键.
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号).
a.离子半径:S2->Na+>O2->H+?b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3?d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P
键长(pm)
74
92
127
141
98
135
101
321
键能(kJ/mol)
436
568
432
368
464
364
391
142
|
根据表中数据,归纳共价键键能与键长的关系______.
参考答案:(1)蛋白质由C、H、O、N元素组成,脂肪由C、H、O元素组成,碳水化合物由C、H、O元素组成,核酸由C、H、O、N、P等元素组成,N的原子序数为7,核外电子排布式为1s22s22p3,由于N的2p能级电子为半充满状态,难以失去电子,所以第一电离能较O大,与它同周期,且单质熔点最高的元素为C,位于周期表第二周期IVA族,
故答案为:N;1s22s22p3;大;第二周期,IVA族;
(2)二氧化碳为含有极性键的非极性分子,电子式为
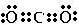
,故答案为:
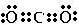
;极性;
(3)a.核外电子排布相同时,核电核数越大,半径越小,则有Na+<O2-,故a错误;
b.金属性:Ca>Mg,则Ca与水反应较Mg剧烈,故b错误;
C.SiO2为原子晶体,熔点最高,故c错误;
D.元素的非金属性:P<S<Cl<F,元素的非金属性越强,对应的单质的氧化性越强,其氢化物的还原性越弱,所以还原性:PH3>H2S>HCl>HF,故d正确,
故答案为:d;
(4)由表中数据可知,同主族元素原子与相同其他原子形成共价键时,原子半径越大,键长越长,键能越小,或同类分子中,键长越小,键能越大.
故答案为:同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大.
本题解析:
本题难度:一般
2、简答题 [化学-物质结构与性质]
硼元素B在化学中有很重要的地位.硼的化合物在农业、医院、玻璃等方面用途很广.请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式______,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为______.
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是______.
(3)在BF3分子中中心原子的杂化轨道类型是______,SiF4微粒的空间构型是______.
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.如图所示是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据图示确定硼化镁的化学式为______.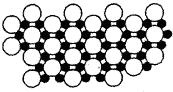
参考答案:(1)Ga是31号元素,其核外有31个电子,根据构造原理知其基态原子核外电子分布式为:[Ar]3d104s24p 1,同一周期,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于其相邻元素,所以B、N、O元素的第一电离能由大到小的顺序为N>O>B,故答案为:[Ar]3d104s24p 1,N>O>B;
(2)原子晶体的硬度与原子半径、键长成反比,N原子和B原子的半径比硅原子小,B-N键长比Si-Si短,所以氮化硼(BN)比晶体硅具有更高硬度和耐热性,故答案为:N原子和B原子的半径比硅原子小,B-N键长比Si-Si短;
(3)在BF3分子中B原子的价层电子对=3,且没有孤电子对,所以中心原子的杂化轨道类型是sp2杂化,SiF4中硅原子含有4个共价键,且不含孤电子对,所以它的空间构型是正四面体型,故答案为:sp2,正四面体;
(4)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为13;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为16.由此可知Mg镁硼原子个数比=16:13=1:2,故硼化镁的化学式为MgB2,故答案为:MgB2.
本题解析:
本题难度:一般
3、选择题 元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为
[? ]
A.9
B.10
C.17
D.18
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列说法正确的是( )
A.磷原子的核外电子排布一定为[Ne]3s23p3
B.基态原子变成激发态原子会释放出能量
C.卤族元素的电负性从上到下逐渐减小
D.元素周期表中P区元素全是非金属元素
参考答案:AC
本题解析:
本题难度:一般
5、选择题 下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量高的电子在离核近的区域绕核旋转
参考答案:A
本题解析:
本题难度:一般