1、选择题 化学用语是学习化学的重要工具。以下化学用语表示错误的是
[? ]
A.质量数之和是质子数之和两倍的水分子符号可能是:D216O
B.NaHCO3水溶液呈碱性的原因:HCO3-+H2O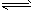 H3O++CO32-
H3O++CO32-
C.基态硫离子的电子排布式:1s22s22p63s23p6
D.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
参考答案:B
本题解析:
本题难度:简单
2、简答题 化学--选修物质结构与性质
下面是C60、金刚石和二氧化碳的分子模型.
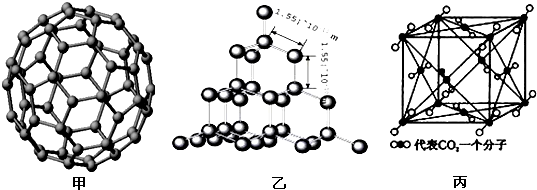
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:______
(2)从晶体类型来看,C60属于______晶体.
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子.观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是______;晶体硅中硅原子与共价键的个数比为______
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个.实际上一个二氧化碳晶胞中含有______个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为______.
(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一.丙烷分子中2号碳原子的杂化方式是______,丙烯分子中2号碳原子的杂化方式是______,丙烯分子中最多有______个原子共平面.
参考答案:(1)硅的原子数序为14,根据能量最低原理可知电子排布式为1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)C60有固定的组成,不属于空间网状结构,熔沸点远低于金刚石等原子晶体的熔沸点,应为分子晶体,故答案为:分子;
(3)金刚石最小的环为六元环,二氧化硅结构跟金刚石结构相似,Si、O原子形成的最小环上应有6个Si原子,硅晶体结构中每个硅与硅的化学键之间插入一个O原子,则Si、O原子形成的最小环上O原子的数目是6,二氧化硅晶体中,每个Si原子与4个O原子形成共价键,每一个共价键中Si的贡献为12,则平均1个Si原子形成2个共价键,所以晶体硅中硅原子与共价键的个数比为1:2,故答案为:6;1:2;
(4)二氧化碳的晶胞中,二氧化碳分子分布于晶胞的定点和面心位置,则晶胞中含有二氧化碳的分子数为8×18+6×12=4,二氧化碳的分子结构为O=C=C,每个分子中含有2个σ键和
2个π键,所以σ键与π键的个数比为1:1,故答案为:4;1:1;
(5)丙烷分子中2号碳原子形成4个σ键,无孤电子对,所以杂化方式是sp3,丙烯分子中2号碳原子碳原子形成3个σ键,无孤电子对,所以杂化方式是sp2,
丙烯中含有乙烯的结构特点,和双键共平面的原子共有6个原子,甲基中含C-H键,原子围绕着σ键旋转,则最多有1个原子和其它6个原子共平面,即丙烯分子中最多有7个原子共平面,故答案为:sp3;sp2;7.
本题解析:
本题难度:一般
3、填空题 A+、B-、C、D四种微粒中均有氢原子,且电子总数均为10个.溶液中的A+和B-在加热时相互反应可转化为C和气体D.则A+为______,B-为______,C和D分别为______、______.
参考答案:常见的10e-的含有H的阴离子有OH-,阳离子有NH4+、H3+O,分子有CH4、NH3、H2O、HF,两种离子能够在加热时发生反应生成两种分子的只能是OH-、NH4+,其离子方程式是
OH-+NH4+═H2O+NH3.即 A+、B-、C、D四种微粒分别为 NH4+、OH-、H2O、NH3.故答案为:NH4+;OH-;H2O;NH3.
本题解析:
本题难度:一般
4、选择题 下列电子排布式属于基态原子的电子排布式的是( )
A.1s22s12p1
B.1s22s22p3
C.1s22s22p63p1
D.1s12s1
参考答案:B
本题解析:
本题难度:简单
5、简答题 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于______晶体;基态Ni原子的电子排布式为______.
(2)配合物
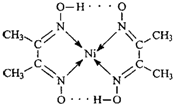
分子内的作用力有______(填编号).
A.氢键? B.离子键? C.共价键? D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.如①CH2=CH2、②CH≡CH、③
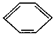
、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点.该晶体的化学式______.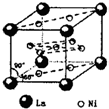
参考答案:(1)配合物Ni(CO)4常温为液态,熔点低,易溶于CCl4、苯等有机溶剂,所以Ni(CO)4属于分子晶体.
Ni元素是28号元素,位于第四周期第Ⅷ族,其基态原子的电子排布式1s22s22p63s23p63d84s2.
故答案为:分子晶体;1s22s22p63s23p63d84s2.
(2)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键.
故选:ACE.
(3)①CH2=CH2中碳原子成2个C-Hδ键,1个碳碳双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
②CH≡CH中碳原子成2个C-Hδ键,1个碳碳三键,三键中含有1个δ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化.
③苯中碳原子成1个C-Hδ键,2个C-Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化.
④HCHO中碳原子成2个C-Hδ键,1个碳氧双键,双键中含有1个δ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化.
故①、③、④采取sp2杂化.
HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,未容纳孤对电子对,全部成δ键,参与成键的原子不同,所以HCHO为平面三角形.
故答案为:①、③、④;平面三角形.
(4)该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为1+8×12=5,晶胞实际含有的镧原子为8×18=1,所以晶体的化学式Ni5La.
故答案为:Ni5La.
本题解析:
本题难度:一般