1、填空题 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)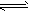 Fe(s)+CO2(g)△H>0。
Fe(s)+CO2(g)△H>0。
(1)其平衡常数可表示为______________, 温度降低,化学平衡移动后达到新的平衡,高炉内CO2和
CO的体积比值____,平衡常数K值_____(本小题空格均备选:增大、减小或不变)
(2)已知1100℃时K=0.263。1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是
υ正___υ逆(选填“大于”、“小于”或“等于”),其原因是___________。
参考答案:(1)c(CO2)/c(CO);减小;减小
(2)否;>;Q<K,平衡正向移动
本题解析:
本题难度:一般
2、填空题 (12分)运用化学反应原理研究元素及其化合物的反应有重要意义。
工业合成氨过程中,N2和H2反应生成NH3:N2(g)+3H2(g) 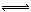 2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
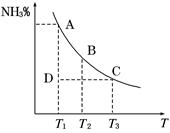
(1)N2(g)+3H2(g) 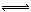 2NH3(g)的ΔH________0(填“>”或“<”)。
2NH3(g)的ΔH________0(填“>”或“<”)。
(2)若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不移动”) 。
(3)若温度为T1时,反应进行到状态D时,v正_____v逆(填“>”、“<”或“=”)。
(4)在体积为5 L的恒温、恒容密闭容器中,起始时投入2 mol N2、3 mol H2,经过10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
①达平衡时N2的转化率=________。
②容器中反应的逆反应速率随时间变化的关系如图。

t2时改变了某一种条件,改变的条件可能是__________、____________________(填写两项)。
参考答案:(12分)每个空2分
(1)<(2)向左(3)> (4)①20% ②升高温度增大氨的浓度
本题解析:(1)根据图像可知,随着温度的升高,NH3的百分含量逐渐减小,说明升高温度,平衡向逆反应方向移动,所以正反应为放热反应,ΔH < 0。
(2)若在恒温、恒压条件下向上述平衡体系中通入氦气,反应体系中气体压强减小,平衡向气体系数增大的方向移动,即向向左移动。
(3)状态D在NH3的百分含量曲线以下,说明NH3的百分含量小于平衡时NH3的百分含量,反应正在向右进行,所以v正> v逆。
(4)①根据“三段式”进行计算,N2 + 3H2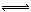 2NH3
2NH3
起始物质的量(mol) 2 3 0
转化物质的量(mol) 0.4 1.2 0.8
平衡物质的量(mol) 1.6 1.8 0.8
则N2的转化率=0.4mol÷2mol×100%=20%。
②根据图像可知t2时逆反应速率增大,平衡向逆反应方向移动,因为N2与H2的反应是放热反应,所以改变的条件可能是:升高温度或增大氨的浓度。
考点:本题考查化学反应速率与化学平衡、图像的分析、化学计算。
本题难度:困难
3、选择题 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8kJ/mol,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化符合图中曲线的是
N2(g)+2CO2(g) △H=-746.8kJ/mol,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化符合图中曲线的是
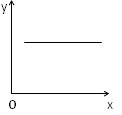
[? ]
A.当X表示温度时,Y表示平衡常数K
B.当X表示温度时,Y表示CO的转化率
C.当X表示N2的物质的量时,Y表示NO的转化率
D.当X表示NO的物质的量时,Y表示平衡常数K
参考答案:B
本题解析:
本题难度:一般
4、填空题 (14分)我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化
步骤及生成物未列出):
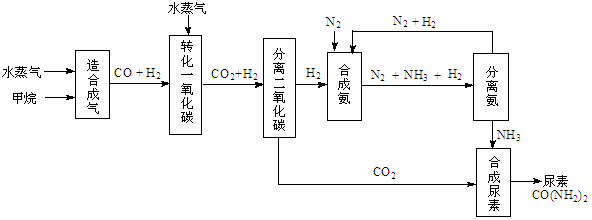
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是???。
A、增大压强?B、升高温度 ?C、充入He气?D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 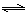 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
提高氢碳比[ n(H2O)/n(CO)],K值?(填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正)?v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是???。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为?,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为???。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成???L 氨气。(假设体积均在标准状况下测定)
参考答案:(16分)(每空2分)(1)B D?(选对1个得1分,只要选错得0分)?
(2)不变;>?(3)A(4)2:1;有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用(5)4.8×108
本题解析:(1)A、增大压强,反应速率加快,平衡向逆反应方向移动,甲烷的转化率降低,故A错误;B、升高温度,反应速率加快,平衡向正反应方向移动,甲烷的转化率增大,故B正确;C、充入He气,反应混合物的浓度不变,反应速率不变,平衡不移动,甲烷的转化率不变,故C错误;D、增大水蒸气浓度,反应速率加快,平衡向逆反应方向移动,甲烷的转化率增大,故D正确;故选BD;(2)平衡常数只受温度影响,与反应物的浓度无关,提高氢碳比[n(H2O)/n(CO)],K值不变;令开始H2O和CO的物质的量都是1mol,某一时刻时CO和CO2的浓度比为1:3,设此时参加反应CO为xmol,则(1-x):x=1:3,解得x=0.75,则:
H2O(g)+CO(g)?H2(g)+CO2(g),
开始(mol):1?1?0?0
变化(mol):0.75?0.75?0.75? 0.75
某时刻(mol):0.25?0.25?0.75?0.75
故产生浓度商Qc=0.75×0.75÷(0.25×0.25)=9<9.94,反应向正反应进行,故v(正)>v(逆);(3)A.固氮指由游离态的氮转化为化合态的氮,合成氨属于人工固氮,故A正确;B.催化剂加快反应速率,不能影响平衡移动,不能提高反应物的利用率,故B错误;C.该反应正反应是放热反应,高温不利用氨气的合成,合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高,故C错误;D.合成氨工业采用循环操作,目的是提高原料的利用率,故D错误;故选A;(4)根据尿素的化学式CO(NH2)2,C、N原子完全利用最后,由C、N原子守恒可知生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1;往往使n(NH3):n(CO2)≥3,这是由于:有利于提高CO2的转化率,且NH3极易溶于水,便于分离、回收利用;(5)由CH4(g)+H2O(g)?CO(g)+3H2(g),N2(g)+3H2(g)?2NH3(g),可得CH4(g)~3H2(g)~2NH3(g),设能够合成氨气的体积为VL,则:
合成气的反应中:CH4——————CO————————3H2,
3.0×108L×60%?3.0×108L×60%?3.0×108L×60%×3
分离二氧化碳过程生成的H2体积:CO~~~~~~~~~~H2,
3.0×108L×60%?3.0×108L×60%?
所以产生的氢气的总体积为3.0×108L×60%×3+3.0×108L×60%=12×108L×60%
令产生氨气的体积为V,则:? 3H2~~~~~~~~~2NH3
3?2
12×108L×60%?V
故V=12×108L×60%×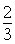 =4.8×108L
=4.8×108L
本题难度:困难
5、选择题 确认能发生化学平衡移动的是
[? ]
A.化学反应速率发生了改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
参考答案:C
本题解析:
本题难度:一般