参考答案:
改变条件
电离平衡移动方向
溶液中c(H+)
PH的变化
KW
升高温度
右
增大
减小
增大
加入酸
左
增大
减小
不变
加入Na
左
减小
增大
不变
本题解析:考查外界条件对电离平衡的影响。
由于电离是吸热的,所以升高温度,促进水的电离。氢离子浓度,pH减小,水的离子积常数增大;加入强酸增大氢离子浓度,抑制水的电离,由于水的离子积常数只与温度有关系,所以是不变的;钠溶于水和水反应生成氢氧化钠,碱性增强,抑制水的电离。
本题难度:一般
3、选择题 某温度下,已知醋酸的电离常数 ,醋酸银的溶度积 ,醋酸银的溶度积 (CH3COOAg )=1.6×10 (CH3COOAg )=1.6×10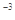 , , (Ag2CO3)="8.3" (Ag2CO3)="8.3" 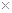 l0 l0 。在不考虑盐类水解的情况下,下列有关说法正确的是 。在不考虑盐类水解的情况下,下列有关说法正确的是
A.醋酸水溶液中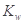 不变,故醋酸对水的电离无影响 不变,故醋酸对水的电离无影响
B.该温度下饱和醋酸水溶液的pH =5-lgl.8
C.该温度下浓度均为0.01 mol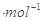 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成
D.将0.02 mol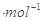 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀
参考答案:D
本题解析:A水是弱电解质,存在电离平衡H2O H++OH-。当向水中加入CH3COOH时,醋酸电离产生的H+使溶液中的H+浓度增大,对水的电离平衡起到了抑制作用。错误。B.PH为溶液中c(H+)的负对数。 H++OH-。当向水中加入CH3COOH时,醋酸电离产生的H+使溶液中的H+浓度增大,对水的电离平衡起到了抑制作用。错误。B.PH为溶液中c(H+)的负对数。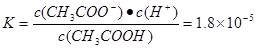 . .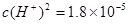 ; ;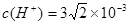 .所以pH="3-" lg .所以pH="3-" lg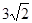 。错误。C.若二者等体积混合,则c(CH3COO-)·c(Ag+)=" 0.005mol/L×0.005mol/L=" 2.5×10-5 mol2/L2 <1.6×10-3=醋酸银的溶度积Ksp (CH3COOAg ).因此不会有CH3COOAg沉淀生成。错误。D.若将0.02 mol/L的Na2CO3溶液与CH3COOAg沉淀上清液等体积混合,c(CO32-)="0.01mol/L;" c(Ag+)=" 1/2×4" ×10-2 mol/L=2×10-2mol/L. c(CO32-)·c(Ag+)2=0.01mol/L×(2×10-2mol/L)2=4×10-6mol3/L3>8.3 ×l0-12.因此会出现Ag2CO3白色沉淀。正确。 。错误。C.若二者等体积混合,则c(CH3COO-)·c(Ag+)=" 0.005mol/L×0.005mol/L=" 2.5×10-5 mol2/L2 <1.6×10-3=醋酸银的溶度积Ksp (CH3COOAg ).因此不会有CH3COOAg沉淀生成。错误。D.若将0.02 mol/L的Na2CO3溶液与CH3COOAg沉淀上清液等体积混合,c(CO32-)="0.01mol/L;" c(Ag+)=" 1/2×4" ×10-2 mol/L=2×10-2mol/L. c(CO32-)·c(Ag+)2=0.01mol/L×(2×10-2mol/L)2=4×10-6mol3/L3>8.3 ×l0-12.因此会出现Ag2CO3白色沉淀。正确。
本题难度:一般
4、填空题 2009年“六·五”世界环境日,中国主题是“减少污染--行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①
② 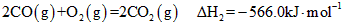
请回答下列问题
(1)反应①的熵变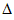 S_________(填“>”或“<”)0。 S_________(填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行? _________(填“可行”或“不可行”)。
(3)反应②中的是不是CO的燃烧热? _________(填“是”或“不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12g C(s)完全燃烧生成CO2(g)时,放出的热量为_________kJ(依据反应①、②计算)。
参考答案:(1)<
(2)不可行
(3)不是
(4)393
本题解析:
本题难度:一般
5、选择题 用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是( )
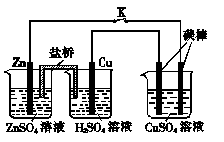
A.铜棒为正极,其电极反应式为2H++2e-===H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为13 g
D.导线中通过电子的物质的量为0.2 mol
参考答案:C
本题解析:A 正确,锌的金属性大于铜,故铜为正极,其电极反应式为2H++2e-=H2↑
B 正确,烧杯右侧碳棒连接原电池的负极,所以是阴极,溶液中的铜离子得电子,有红色物质析出。
C 错误,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。相当于转移了0.2mol电子,根据转移电子数相等,反应中消耗锌的质量为6.5 g
D 正确,由c 可得,转移了0.2mol电子。
本题难度:简单
|