1、选择题 常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法不合理的是
A.反应后HA溶液可能有剩余
B.生成物NaA的水溶液的pH可能小于7
C.HA溶液和NaOH溶液的体积可能不相等
D.HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等
参考答案:B
本题解析:HA溶液可能是强酸溶液,也可能是弱酸溶液;所以
A合理,若HA溶液为强酸溶液,当与NaOH溶液混合后pH=7,HA溶液不可能剩余,若HA溶液为弱酸溶液,当与NaOH溶液混合后pH=7,HA溶液有剩余;
B不合理,生成物NaA的水溶液的pH可能大于7也可能等于7,但一定不小于7;
C合理,溶液的体积多少与溶液的浓度有关;D合理,若HA溶液为弱酸,则HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等
本题难度:一般
2、选择题 对于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是(? )
A.该酸式盐的水溶液一定显酸性
B.在该盐溶液中,离子浓度为c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.若HY-能水解,水解方程式为HY-+H2O Y2-+H3O+
Y2-+H3O+
D.若HY-能电离,电离方程式为HY-+H2O Y2-+H3O+
Y2-+H3O+
参考答案:D
本题解析:NaHY溶液由于Y2-没有指定,常见的有三种情况:①NaHSO4,只电离,不水解;②NaHSO3,其水溶液中HSO3-电离程度大于水解程度,溶液显酸性;③NaHCO3、NaHS,其水溶液中HCO3-、HS-水解程度大于电离程度,溶液显碱性。因Y2-不确定,故A、B错误。C式为电离方程式而非水解方程式。
本题难度:一般
3、选择题 醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关0.1mol·L-1醋酸钡溶液中粒子浓度的比较中错误的是
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
参考答案:A
本题解析:本题虽然是一道常规题型,考察电解质溶液中的三个守衡,但(CH3COO)2Ba的设置注重对电解质溶液知识的深刻理解,思维用量远比常见的NaAc大,起到强化理解的作用。
本题难度:一般
4、填空题 (1)氯化铝水溶液呈?性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示):?。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式)?。实验室在保存AlCl3溶液时,常在溶液中加少量的?,以?(填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈?性(填“酸性”,“中性”或“碱性”),溶液中c(Na+)??c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+)??c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈?性,(填“酸性”,“中性”或“碱性”),醋酸体积?氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-)??c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因?(用离子浓度关系式表示)。
参考答案:(1)酸,AI3++3H2O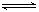 AI(OH)3+3H+? AI2O3? HCI?抑制?
AI(OH)3+3H+? AI2O3? HCI?抑制?
(2)碱, c(Na+)>c(CH3COO-)。(3)酸, c(Na+)<c(CH3COO-) 。
(4)中,>。(5)c(CO32-)<c(OH-),2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+)
本题解析:(1)氯化铝是强酸弱碱盐,水解显酸性,方程式是AI3++3H2O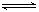 AI(OH)3+3H+。水解是吸热的,加热促进水解,且生成的氯化氢挥发,所以最终生成的是氢氧化铝,灼烧则得到氧化铝。所以实验室在保存AlCl3溶液时,常在溶液中加少量的盐酸,以抑制氯化铝的水解。
AI(OH)3+3H+。水解是吸热的,加热促进水解,且生成的氯化氢挥发,所以最终生成的是氢氧化铝,灼烧则得到氧化铝。所以实验室在保存AlCl3溶液时,常在溶液中加少量的盐酸,以抑制氯化铝的水解。
(2)醋酸和氢氧化钠的物质的量相等,恰好反应,生成醋酸钠。醋酸钠水解,溶液显碱性。所以根据电荷守恒定律可知,c(Na+)>c(CH3COO-)。
(3)由于醋酸是弱酸,所以pH=3的醋酸的浓度大于0.001mol/L,则在和氢氧化钠反应时,醋酸是过量的,所以溶液显酸性。所以根据电荷守恒定律可知,c(Na+)<c(CH3COO-)。
(4)根据电荷守恒定律可知,当溶液中醋酸根离子和钠离子浓度相等是,氢离子浓度等于OH-浓度,溶液显中性。这说明醋酸应该是过量的,所以醋酸的体积大于氢氧化钠溶液的体积。
(5)0.1 mol·L-1的NaHCO3溶液PH=9,这说明碳酸氢钠的水解程度大于碳酸氢钠的电离程度,所以溶液中c(CO32-)<c(OH-)。根据电荷守恒定律可知,离子浓度的关系是2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+)。
本题难度:一般
5、选择题 下列叙述中正确的是
A.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH )
B.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液混合后溶液显碱性,一定有:
c(H+) < c(OH- )< c(A-) <c(Na+)
C.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,体积为20 mL,则溶液的pH = 12+lg2
D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-)
参考答案:A
本题解析:酸越弱,相应的钠盐越容易水解,酸性是醋酸>碳酸>苯酚>碳酸氢钠,所以碳酸钠的水解程度最大,碱性最强。由于氢氧化钠是强碱,因此在pH相同的条件下,氢氧化钠的浓度最小,所以选项A正确。B中HA如果是强酸,则氢氧化钠过量,溶液才能显碱性。但如果HA是弱酸,则要使溶液显碱性,则氢氧化钠也是过量的,所以c(OH- )就可以大于c(A-) 的,B不正确。
C中碱过量,所以反应后的溶液中c(OH- )=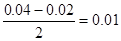 mol/L,所以pH=12,C不正确。
mol/L,所以pH=12,C不正确。
D中生成物是氢氧化铝、氯化铝和氯化钠,所以c(Al3+)>c(H+),D不正确。答案选A。
本题难度:一般