1、填空题 (1)已知:25℃时,一些弱电解质的电离常数如下:NH3·H2O:1.77×10—5? H2CO3:4.3×10—7(第一步电离)。则:NH4HCO3溶液显?性 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈?性,醋酸体积?(填“>”、“<”、“=”)氢氧化钠溶液体积。
(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,A溶液呈碱性的原因是(用离子方式程式表示)________________
(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:?;有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请您运用所学知识解释?
(5)已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15。在AB2、AC均为饱和的混合液中,测得c(B—)=1.6×10—3 mol·L-1,则溶液中c(C2—)为?mol/L。
2、填空题 (16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图
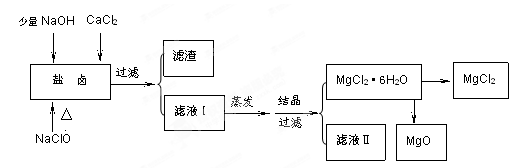
(1)滤液Ⅱ中所含主要的杂质离子是?(写离子符号)。
(2) 加入NaClO的作用是?。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
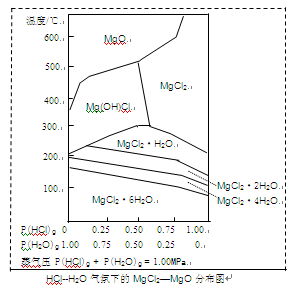
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式?;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
?;若要得到无水MgCl2须采取的措施是?。
3、选择题 物质的量浓度相同的一元强碱和一元强酸相互反应时,溶液
A.呈酸性
B.呈碱性
C.呈中性
D.酸碱性无法判断
4、选择题 下列关于各溶液的描述中正确的是? ( )。
A.pH相等的①NH4Cl,②(NH4)2SO4,③NH4HSO4的溶液中,c(NH4+)大小:①=②=③
B.常温下,在10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20 mL
C.向1.00 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g,所得溶液中:3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)]
D.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
5、选择题 下列溶液中有关粒子的物质的量浓度关系正确的是?(?)
A.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
B.25℃时,pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+)
C.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
D.等物质的量的Na2CO3、NaHCO3的混合溶液中:
c(CO32-)+2c(OH-)=c(HCO3-)+c(H2CO3)+2c(H+)