1、选择题 设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下C2H4气体22.4L,所含电子数为16NA
B.0.1mol铁在纯氧中充分燃烧,失电子数为0.3NA
C.1L 0.2mol/L的氯化铁溶液中,氯离子数为0.6NA
D.室温下,16g甲烷含有共价键数为4NA
参考答案:B
本题解析:A、正确;B、铁在纯氧中充分燃烧生成四氧化三铁,0.1mol铁在纯氧中充分燃烧,失电子数为0.1×8/3NA,错误;C、1×0.2×3=0.6mol,正确;D、正确。
本题难度:一般
2、选择题 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为?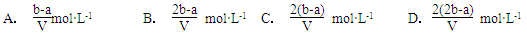
参考答案:D
本题解析:消耗氢氧化钠是amol,则每一份溶液中镁离子是0.5amol;消耗氯化钡是bmol,所以每一份中SO42-是bmol,则硫酸钾的物质的量是(b-0.5a)mol,所以每一份中钾离子的物质的量是(2b-a)mol,浓度是(2b-a)mol÷0.5VL,答案选D。
本题难度:一般
3、选择题 下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
A.200mL,0.5mol?L-1的FeCl3溶液
B.100mL,0.5mol?L-1的MgCl2溶液
C.150mL,1mol?L-1的NaCl溶液
D.50mL,0.5mol?L-1的CuCl2溶液
参考答案:A、200ml 0.5mol/L的FeCl3溶液中Cl-离子的物质的量浓度为0.5mol/L×3=1.5mol/L;
B、100mL 0.5mol/L的MgCl2溶液中Cl-离子的物质的量浓度为0.5mol/L×2=1mol/L;
C、150mL1mol/L的NaCl溶液中Cl-离子的物质的量浓度为1mol/L×1=1mol/L;
D、50m L0.5mol/LCuCl2溶液中Cl-离子的物质的量浓度为0.5mol/L×2=1mol/L,
显然A中Cl-离子的物质的量浓度最大;
故选A.
本题解析:
本题难度:简单
4、选择题 下列叙述正确的是
A.摩尔是国际上规定的七个基本物理量之一
B.不同的气体,若体积不等,则它们所含的分子数一定不等
C.一定温度、压强下,各种气态物质分子间距离近似相等
D.气体的摩尔体积为22.4L/mol
参考答案:C
本题解析:A、摩尔是物质的量的单位,不是物理量,A不正确;B、气体的分子数与气体的物质的量有关系,与气体的体积并无直接关系,因此不同的气体,若体积不等,则它们所含的分子数也可能相等,B不正确;C、在一定温度、压强下,各种气态物质分子间距离近似相等,C正确;D、在标准状况下气体的摩尔体积为22.4L/mol,摩尔体积与温度和压强有关系,在其它状态下不一定22.4L/mol,D不正确,答案选C。
本题难度:简单
5、选择题 取质量为44g的Zn、Fe、Al三种金属构成的混合物粉末,与一定质量的20%硫酸溶液恰好完全反应,得到无水盐140g,则生成气体的体积(标准状况下)为
A.11.2L
B.22.4L
C.33.6L
D.44.8L
参考答案:B
本题解析:蒸发后的固体为混合物,反应前的固体是三种金属的质量为44g,所以140g-44g=96g为硫酸根的质量,在硫酸中,氢元素与硫酸根的质量比为(1×2):96,则硫酸中含氢的质量为2g,所以产生的氢气的物质的量为1mol,其标准状况下体积为22.4L,故选B。
点评:本题考查质量守恒定律的灵活运用和解答问题的能力
本题难度:一般