1、选择题 下列实验中,合理的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.用100mL 量筒量取5.20mL 盐酸
C.用托盘天平称取25.20g NaCl固体
D.用100mL 容量瓶配制125mL 0.1mol·L-1盐酸
参考答案:A
本题解析:略
本题难度:简单
2、选择题 为验证淀粉水解可生成还原性糖进行了下列实验,该实验中操作步骤的排列顺序正确的是( ? )
①取少量淀粉加水制成悬浊液? ②加热煮沸
③加入新制的Cu(OH)2悬浊液? ④加几滴稀硫酸
⑤再加热直至沸腾? ⑥加入碱液,中和直至溶液呈碱性
A.①②④⑤③⑥
B.①④②③⑤⑥
C.①④②⑥③⑤
D.①⑤③④⑥②
参考答案:C
本题解析:淀粉水解的实验的步骤为:取少量纯淀粉加适量水配成溶液;在淀粉溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;由于水解完毕生成还原性糖葡萄糖,与新制Cu(OH)2悬浊液发生氧化反应,须在碱性条件下,所以,在冷却后的溶液中先加入NaOH溶液调pH至碱性,然后再加入新制Cu(OH)2悬浊液溶液,水浴加热,其实验结果有砖红色沉淀产生。所以该实验中操作步骤的排列正确顺序为:①④②⑥③⑤,答案选C。
点评:该题紧扣教材基础知识,主要是考查了淀粉水解,以及新制Cu(OH)2悬浊液试剂与葡萄糖发生氧化反应的条件,注意该操作的前后顺序,题目较简单,有利于培养学生的逻辑思维能力和规范严谨的实验设计能力。
本题难度:简单
3、实验题 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
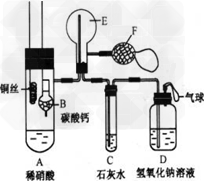
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作为_______________。如何确定E中空气已被赶尽____________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为_________________。
(3)如何证明E中收集到的是NO而不是H2?________________?。一段时间后,C中白色沉淀溶解,其原因是_______________。
(4)装置D的作用是_____________________。
参考答案:(1)将装CaCO3的干燥管下移与稀HNO3反应产生CO2;当C处出现白色沉淀时
(2)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(3)用F向E中鼓入空气,E内颜色加深;NO2进入C生成HNO3使CaCO3溶解
(4)吸收过量的NO2,防止空气污染
本题解析:
本题难度:一般
4、选择题 下列实验不能达到预期目的的是
代号
| 实?验
| 实验目的
|
A
| Cl2、Br2分别与H2反应
| 比较氯与溴的非金属性强弱
|
B
| 同温下测定相同浓度的Na2CO3,
和Na2SO4溶液的酸碱性
| 比较硫酸与碳酸的酸性强弱
|
C
| AlCl3、MgCl2溶液中通人过量氨气
| 比较镁与铝单质的还原性强弱
|
D
| 同温下用同一电路分别测定同浓度的
盐酸和某一元酸溶液导电能力
| 比较该一元酸与盐酸酸性的强弱
参考答案:C
本题解析:非金属性越强,其单质与氢气的化合就越容易,A能够达到实验目的;非金属性越弱,最高价氧化物的水化物的酸性就越弱,相应的钠盐就越容易水解,碱性就越强,所以选项B可以达到目的;金属性强弱和金属阳离子与氨水的反应无关系,C不正确;酸越强,在相同条件下溶液的导电性就越强,则选项D也能达到目的,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该题的关键是明确金属性和非金属性的判断依据,然后结合题意灵活分析、判断即可。
本题难度:简单
5、简答题 为探究氯气的性质,某同学做了如图1所示的实验,将少量试剂分别放入培养皿中的相应位置,已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.请回答下列问题:
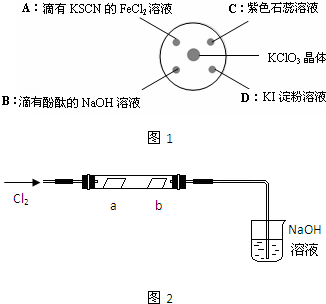
(1)用单线桥表示生成氯气的反应电子转移的方向和数目:______
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)实验A的现象是______,反应的离子方程式为______.
(3)实验D的现象是______,反应的离子方程式为______,
这一实验说明氧化性Cl2______I2(填“>”或“<”).
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为______.为了探究褪色原因,这位同学又做了如图2所示实验,将干燥的氯气通入双通管中,其中a为干燥的红纸条,b为湿润的红纸条.
①实验现象是:a______,b______.NaOH溶液的作用______.
②该实验说明具有漂白作用的物质是______.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是______(用化学方程式表示).
(5)实验B的实验现象是______,工业上利用与实验B类似的反应制备漂白粉,制漂白粉的化方程式为______.
参考答案:(1)反应中KClO3为氧化剂,得电子,HCl为还原剂,失电子,由化合价的变化可知转移电子方向和数目可表示为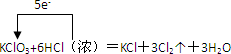 , ,
故答案为: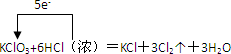 ; ;
(2)氯气氧化Fe2+生成Fe3+,溶液变红,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:浅绿色溶液变为红色溶液;2Fe2++Cl2=2Fe3++2Cl-;
(3)氯气氧化KI生成碘,试纸变成蓝色,反应的方程式为2I-+Cl2=I2+2Cl-,氧化剂氧化性大于氧化产物氧化性,则氧化性Cl2较强,
故答案为:无色溶液变为蓝色;2I-+Cl2=I2+2Cl-;>;
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
①干燥的氯气不具有漂白性,氯气与水反应,生成具有漂白性的HClO,则b褪色,由于氯气有毒不能排放到空气中,应用NaOH溶液吸收,
故答案为:不褪色;褪色;吸收Cl2,防止污染空气.
②a和b向比较,b中含有HClO,具有漂白性,故答案为:HClO.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是次氯酸不稳定,见光易分解,反应的方程式为2HClO光.2HCl+O2↑,
故答案为:2HClO光.2HCl+O2↑;
(5)氯气和氢氧化钠反应,可观察到红色溶液褪色,与氢氧化钙反应生成氯化钙和次氯酸钙,反应的方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:红色溶液褪色;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O.
本题解析:
本题难度:一般
|