1、选择题 对可逆反应4NH3(g)+ 5O2(g)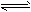 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
[? ]
A.达到化学平衡时,4v正(O2)= 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)
参考答案:A
本题解析:
本题难度:一般
2、选择题 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)?nY(g);△H=Q?kJ/mol.反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
| /L积体气温体c(Y)/mol?L-1度/℃ | 1 | 2 | 3
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
|
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
参考答案:A.在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,则有m<n,故A错误;
B.当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为吸热反应,则Q>0,故B错误;
C.温度不变,压强增大,平衡向逆反应方向移动,则Y的质量分数减少,故C正确;
D.反应的正向为吸热反应,体积不变,温度升高,平衡正向移动,故D错误.
故选C.
本题解析:
本题难度:一般
3、填空题 在一个容积为5L的密闭容器中,通入NH3和O2,它们的物质的量之比为1:2,发生如下反应:4NH3+5O2
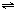
4NO+6H2O(g).
(1)上述反应在一定条件下2min后达到平衡,含NH32mol,已知NH3的转化率20%,若以NO浓度变化表示该反应的平均反应速率为______,O2的平衡浓度为______.
(2)在达到平衡后,加入相当于原组成气体1倍的惰性气体,如果容器的容积不变,则平衡______移动;如果保持总压强不变,则平衡______?移动.
参考答案:(1)根据三段式解题法,表示出反应混合物各组分物质的量的变化量、平衡时各组分的物质的量.
令开始通入的氨气的物质的量为nmol,则
? ?4NH3 +5O2

4NO+6H2O,
开始(mol):n? 2n? ? ?0? 0
变化(mol):0.2n? 0.25n?0.2n? 0.3n
平衡(mol):0.8n?1.75n? 0.2n? 0.3n
所以0.8n=2,解得n=2.5
以NO表示的平均反应速率为v(NO)=2.5mol×0.25L2min=0.05mol/(L?min).
O2的平衡浓度为2.5mol×1.755L=0.875mol/L.
故答案为:0.05mol/(L?min);0.875mol/L
(2)容积不变,加入惰性气体,反应混合物各组分的浓度不变,平衡不移动;
总压强不变,容器容积增大,等效为减小压强,平衡向体积增大的方向移动,即向右移动.
故答案为:不;向右
本题解析:
本题难度:一般
4、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成
l mol产物的数据)。
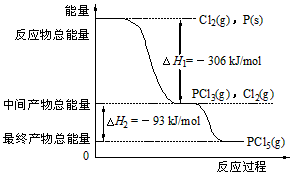
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________________________。上述分解反应是一个可逆反应。温度Tl时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率al等于_____________;若反应温度由Tl升高到T2,平衡时PCl5的分解率为a2,a2_________ al(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________。
(4)P和Cl2分两步反应生成1mol PCl5的△H3 = ________________,一步反应生成1mol PCl5的△H4
______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是:____________________________。
参考答案:(1)P(s)+Cl2(g)=PCl3(g) △H=-306kJ·mol-1
(2)PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ·mol-1;25%;大于
(3)两步反应都放热反应,降温有利于提高产率,防止产物分解
(4)-399kJ·mol-1;等于
(5)PCl3+4H2O==H3PO4+5HCl
本题解析:
本题难度:一般
5、计算题 (10分)某化学反应2A(g)  B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(
B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度( )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表:
实验
序号
|
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 800℃
| C2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| C3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20分钟内用A表示的平均速率为 ____________ 。
(2)在实验2中,A的初始浓度C2=  ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填>、=、<),且C3=  。
。
(4)由上述实验,可推测该反应是 反应(选填“吸热”或“放热”)。理由是:
。
(5)1~4组实验中,A的平衡转化率最大的是第 组。
(6)在实验2中,50 min后,若将容器体积增大1倍,则达平衡时B的浓度为 _____  ;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
参考答案:(1)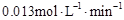 (1分) (2)1.0 (1分)使用了催化剂(1分)
(1分) (2)1.0 (1分)使用了催化剂(1分)
(3)>(1分) C3= (1分)(提示:利用相同温度下平衡常数不变进行计算。)
(1分)(提示:利用相同温度下平衡常数不变进行计算。)
(4)吸热(1分) 实验4和1比较,温度升高,A的平衡浓度减小,平衡向正反应方向移动,则正反应是吸热反应(1分)
(5)4(1分) (6) (1分);不变(1分)。
(1分);不变(1分)。
本题解析:(1)在实验1中,反应在10~20分钟内A的浓度减少了0.80mol/L-0.67mol/L=0.13mol/L,所以反应速率是0.13mol/L÷10min=0.013mol/(L·min)。
(2)在实验2中,平衡状态和实验1相同,所以A的起始浓度是1.0mol/L.但达到平衡的时间少,说明反应速率快,因此使用了催化剂。
(3)在实验1、3中,反应在10~20分钟内A的浓度分别减少了0.13mol/L和0.17mol/L,所以υ3>υ1。由于温度不变,所以平衡常数不变,即
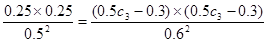 ,解得C3=1.20mol/L。
,解得C3=1.20mol/L。
(4)实验4和1比较,温度升高,A的平衡浓度减小,说明平衡向正反应方向移动,所以正反应是吸热反应。
(5)在实验4中A的平衡浓度最小,说明转化率最大,所以答案选实验4。
(6)实验2中B的平衡浓度是0.25mol/L,由于反应前后体积不变,所以改变压强平衡不移动,因此B的浓度变为0.125mol/L。平衡常数与温度有关系,所以不变。
本题难度:一般