1、选择题 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中正确的是
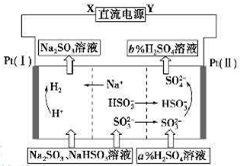
A.X为直流电源的正极,Y为直流电源的负极
B.阳极区pH减小
C.图中的b<a
D.阴极的电极反应为HSO3——2e—+H2O=SO42—+3H+和 SO32——2e—+2H2O=SO42—+4H+
参考答案:B
本题解析:因为电解池左室H+→H2,Pt(I)是阴极,X为直流电源的负极,A错误;电解池右室阳极区的发生反应HSO3——2e—+H2O=SO42—+3H+?和 SO32——2e—+2H2O=SO42—+4H+,故pH减小,B正确;D错误;C.图中的b<a
本题难度:一般
2、选择题 把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将所得溶液用石墨做电极进行电解,阳极生成的物质是:
A.H2
B.Ag
C.Cl2
D.O2
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (18分)(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
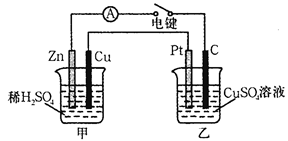
(1)甲装置的名称是_____(填“原电池”或“电解池”)。
(2)写出电极反应式:Pt极 ;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_______(填“变深”、“变浅”或“无变化”)。
(4)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为 。(用NA表示)
(Ⅱ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。
(1)欲使铁制品表面镀铜,应以_______为阳极,电解质溶液为 。
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为 。
参考答案:Ⅰ.(1)原电池;(2)2Cl--2e-=Cl2↑、 6.4g;(3) 变深 ;(4) 0.4NA;
Ⅱ.(1) 铜 、硫酸铜或氯化铜溶液 ;(2) 氯化钠溶液
本题解析:(Ⅰ)(1)根据图中的铜、锌两种电极和电解质稀硫酸构成闭合电路知:该装置为原电池,Zn活泼,则Zn作负极,Cu作正极,发生电池反应为Zn+H2SO4
本题难度:一般
4、选择题 高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸眭条件下不稳定),总反应式为:Fe+2H2O+20H- 3H2↑+FeO42-。下列说法正确的是
3H2↑+FeO42-。下列说法正确的是
A.铁为阳极,H2SO4为电解液
B.铁为阴极,浓NaOH为电解液
C.阳极发生的电极反应为:Fe+80H--6e-=====4H20+Fe042-
D.铁失去3mol电子可以在阴极得到33.6L氢气
参考答案:C
本题解析:有反应式知铁为阳极,浓NaOH为电解液,铁失去6mol电子可以在阴极得到33.6L氢气,因此选C。
本题难度:一般
5、填空题 某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。
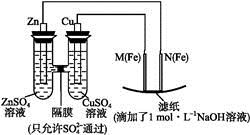
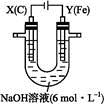
图1 图2
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.铝
B.石墨
C.银
D.铂
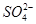 (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。 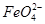 )在溶液中呈紫红色。
)在溶液中呈紫红色。
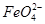 +4H2O和 。
+4H2O和 。  Fe2O3+ZnO+2K2ZnO2
Fe2O3+ZnO+2K2ZnO2