1、选择题 用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( )
A.阳极上析出11.2 mL O2(标准状况)
B.阴极上析出32 mg Cu
C.阴极上析出11.2 mL H2(标准状况)
D.阳极和阴极质量都无变化
参考答案:B
本题解析:A.当有1×10-3 mol的OH-放电时,则n(e-)=1×10-3 mol.在阳极发生反应:4OH--4e-= O2↑+2H2O。n(O2)= 1×10-3 mol×1/4=2.5×10-4 mol.V(O2)= 2.5×10-4 mol×22.4L/mol=5.6×10-3L=5.6 ml.误。B.在阴极由于放电能力Cu2+>H+。所以电极反应为Cu2++2e-=Cu。在整个闭合回路中电子转移数目相等,所以n(Cu)= 1/2×10-3 mol=5×10-4 mol.m(Cu)=64g/mol×5×10-4 mol=32mg.正确。C.在阴极是Cu离子放电得到Cu单质,不会放出氢气。错误。D.由于在阴极Cu2+放电产生Cu附着在电极上,所以阴极质量会增加;而阳极上是OH-放电产生氧气,所以阳极的质量无变化。错误。
本题难度:一般
2、填空题 某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式。
参考答案:第一阶段的反应:CuCl2 Cu+Cl2↑
Cu+Cl2↑
第二阶段的反应:2H2O 2H2↑+O2↑
2H2↑+O2↑
本题解析:该溶液由Cu(NO3)2、MgCl2和H2O三种物质组成,其中含有H+、Cu2+、Mg2+三种阳离子和 、Cl-、OH-三种阴离子。H+、Cu2+、Mg2+在阴极上放电的先后顺序是Cu2+>H+>Mg2+,
、Cl-、OH-三种阴离子。H+、Cu2+、Mg2+在阴极上放电的先后顺序是Cu2+>H+>Mg2+, 、Cl-、OH-在阳极上放电的先后顺序是Cl->OH->
、Cl-、OH-在阳极上放电的先后顺序是Cl->OH-> 。溶液中的OH-和H+均来自难电离的H2O。电极反应式为:
。溶液中的OH-和H+均来自难电离的H2O。电极反应式为:
第一阶段?阳极:2Cl--2e-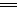 Cl2↑
Cl2↑
阴极:Cu2++2e-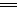 Cu
Cu
第二阶段?阳极:2H2O-4e-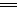 O2↑+4H+
O2↑+4H+
阴极:4H2O+4e-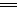 2H2↑+4OH-
2H2↑+4OH-
将电极反应式合并得电解反应的化学方程式。
本题难度:一般
3、填空题 银锌电池广泛用作各种电子仪器的电源,它的充电放电过程可表示为:2Ag+Zn(OH)2=Ag2O+Zn+H2O
回答下列有关问题:
(1)电池的放电过程是______________(填“①”或“②”)。
(2)该电池属于______________ (填“酸”“碱”或“中”)性电池。
(3)反应①是______________ (填“放热”或“吸热”)反应。
(4)写出充电时的电极反应式:
阳极:___________________________________________________________。
阴极:___________________________________________________________。
(5)充电时,电池的正极应接电源的______________极。
(6)试简述回收该种废电池的意义__________________________________________________。
参考答案:
(1)②
(2)碱
(3)吸热
(4) 2Ag+2OH--2e-=Ag2O+H2O? Zn(OH)2+2e-=Zn+2OH-
(5)正
(6)可减少重金属Ag+对环境的污染,又可将Ag回收利用。
本题解析:关键是准确判断①②哪个是放电过程和充电过程。原电池反应是自发反应,由性质可知Ag2O有强氧化性,Zn有强还原性,所以②是自发反应,即放电反应。
本题难度:一般
4、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O.有关该电池的说法中,不正确的是
Cd+2NiOOH+2H2O.有关该电池的说法中,不正确的是
[? ]
A.放电时,电解质溶液中的OH-向负极移动
B.充电过程是电能转化为化学能的过程
C.放电时,负极附近溶液的碱性不变
D.充电时阴极反应为:Cd(OH)2+2e-===Cd+2OH-
参考答案:C
本题解析:
本题难度:一般
5、选择题 金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-═Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
参考答案:A、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+,Fe-2e-=Fe2+;Zn-2e-=Zn2+;故A错误;
B、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,故B错误;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+;故C错误;
D、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确;
故选D.
本题解析:
本题难度:简单