|
1、选择题 将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中固体X、液体Y及检测方法对应关系有错误的是
选项
| 固体X
| 液体Y
| 检测方法
| A
| CaO
| 浓氨水
| 蘸有浓盐酸的玻璃棒
| B
| Cu
| 浓硫酸
| 沾有氯化钡溶液的玻璃片
| C
| MnO2
| 双氧水
| 带火星的木条
| D
| NaHCO3
| 醋酸溶液
| 沾有澄清石灰水的玻璃片
2、实验题 (每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题:

(1)若向A中通入足量的二氧化硫气体,A中的现象是?。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和?性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是?。
3、选择题 浓硫酸不具有的性质是
A.吸水性
B.脱水性
C.挥发性
D.强氧化性
4、选择题 银耳本身为淡黄色,有一种雪耳,颜色洁白如雪,其制作过程是:将银耳放在塑料棚内,在棚一端支个小锅,锅内放硫磺,加热使其熔化并燃烧,两天左右,雪耳就制成了,雪耳炖不烂,且对人有害,制作雪耳利用的是
A.S的还原性
B.S的漂白性
C.SO2的还原性
D.SO2的漂白性
5、实验题 测定生成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔点是16.8oC,沸点是44.8oC)
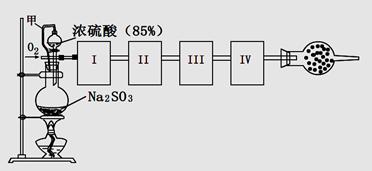
(1)装置中甲管的作用是__________________。
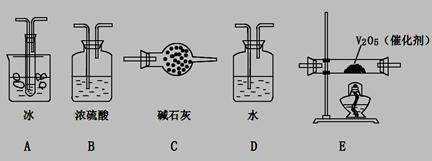
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从下图A?E装置中选择最适合装置并将其序号填至下面的空格中,每个装置不重复使用。
I、 II、III、IV处连接的装置分别是?。
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______? ②原因 :______?③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为?
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为?。(用含m、n的代数式填写)
|
|