1、选择题 标况下,电解一定物质的量浓度的CuSO4溶液一段时间后,加入0.2molCu(OH)2固体使溶液完全恢复到初始状态,则此过程中共产生气体( )
A.6.72L
B.8.96L
C.11.2L
D.5.6L
参考答案:Cu(OH)2从组成上可看成CuO?H2O,加入0.2mol Cu(OH)2固体使溶液完全恢复到初始状态,根据“出什么加什么”的原则知,电解析出的物质是氧气、铜和氢气,根据原子守恒得:氧元素全部生成形成氧气,氢元素全部形成氢气,根据氢氧化铜中氢氧元素计算氢气和氧气的体积.
设生成氧气的体积为x,氢气的气体为y.
根据原子守恒,氢氧化铜和氧气、氢气的关系式为:
Cu(OH)2-----O2
1mol? 22.4L
0.2mol? x
x=4.48L
Cu(OH)2---H2
1mol? 22.4L
0.2mol? y
y=4.48L
所以共产生的气体体积=x+y=4.48L+4.48L=8.96L
故选B.
本题解析:
本题难度:一般
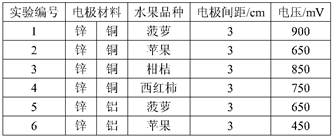
2、选择题 甲乙两位同学一起做水果电池的实验,测得数据如下:
 ?
?
甲同学提出的问题,乙同学解释不正确的是
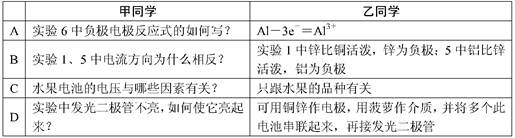
参考答案:C
本题解析:水果电池的电压与电极的材料也有很大的关系。
本题难度:简单
3、选择题 原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是?
A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+
B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+,
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
参考答案:B
本题解析:选项A:该原电池中,铝易失去电子而作负极,铜作正极,故A正确;
选项B:由Mg、Al、NaOH溶液组成原电池,铝和氢氧化钠反应易失去电子而作负极,镁作正极,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O,故B不正确;
选项C:该原电池中,铁易失去电子而作负极,铜作正极,其负极反应式为:Fe-2e-═Fe2+,故C正确;
选项D:Al、Cu、浓硝酸组成原电池,铝钝化,所以铜作负极,铝作正极,其负极反应式为:Cu-2e-=Cu2+,故D正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强,注重答题的灵活性,有利于培养学生的逻辑思维能力和发散思维能力。答题时注意不能根据金属的活泼性确定原电池的正负极,要根据电极反应类型判断原电池的正负极。
本题难度:简单
4、选择题 设想通过原电池反应以H2和Cl2为原料生产盐酸。关于这种原电池的设想正确的是
[? ]
A.正极反应为H2-2e-=2H+
B.在电池工作时,H+移向负极
C.负极附近可观察到苍白色火焰
D.以盐酸作为电解质,并不断补充蒸馏水,以维持溶液一定的pH
参考答案:D
本题解析:
本题难度:一般
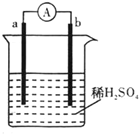
5、选择题 如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
A.碳棒上有气体放出
B.a是正极,b是负极
C.导线中有电子流动,电子从a极流到b极
D.a极上发生了氧化反应