1、简答题 下列实验操作或结论正确的是______(填序号).
A.制取乙酸乙酯时,把乙酸和乙醇依次加入到浓硫酸中
B.向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后不再溶解
C.将甲烷和乙烯的混合气体通入盛有足量溴的四氯化碳溶液中,可除去乙烯
D.分别向少量酸性KMnO4溶液和溴的四氯化碳溶液中滴入苯,均不退色,说明苯分子内不存在一般的碳碳双键
E.在实验室制取气体时,必须进行气密性的检查,且该操作应放在连接装置后,装药品之前.
参考答案:A.制取乙酸乙酯时,先加乙醇,再慢慢滴加浓硫酸,冷却后加乙酸,减少乙酸的恢发,故A错误;
B.向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后又溶解,盐析为可逆过程,故B错误;
C.乙烯与溴反应,而甲烷不反应,则将甲烷和乙烯的混合气体通入盛有足量溴的四氯化碳溶液中,可除去乙烯,故C正确;
D.苯与高锰酸钾、溴水均不反应,则说明苯分子内不存在一般的碳碳双键,故D正确;
E.制取气体时,连接好装置,应先检查气密性,再加药品,符合制取气体的一般操作步骤,故E正确;
故答案为:CDE.
本题解析:
本题难度:一般
2、选择题 下列实验装置的有关表述错误的是( )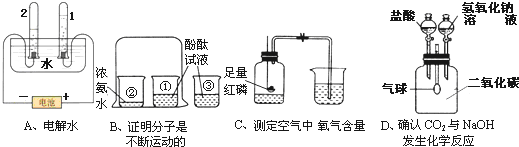
A.A实验试管2中产生的气体是氢气
B.B实验中烧杯③的作用是对比①
C.对于C实验,实验前夹紧止水夹,冷却后再打开止水夹
D.D实验中,气球的变化情况是先变小后变大
参考答案:D
本题解析:
本题难度:简单
3、简答题 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要材料.现有一块已知质量为56.4g的镁铝合金,欲测定其中镁的质量分数,两位同学设计了不同的实验方案.
实验设计Ⅰ:
镁铝合金
溶液?过滤,得到沉淀质量为5.8g
实验设计Ⅱ:…
请回答以下问题:
(1)写出实验设计Ⅰ中反应①的离子方程式______;______.
(2)依据实验设计Ⅰ,求出镁的质量分数.(要求写计算过程)
(3)请你为另一位同学设计第Ⅱ种测定镁的质量分数的方案.(写出必要的实验过程)
参考答案:(1)金属镁和铝金能和盐反应生成对应的盐酸盐和氢气,实质是:Mg+2H+=Mg2++H2↑,2A1+6H+=2A13++3H2↑,故答案为:Mg+2H+=Mg2++H2↑,2A1+6H+=2A13++3H2↑;
(2)设合金中Mg的质量为x,根据镁元素守恒,则
Mg~MgC12~Mg(OH)2↓
24?58
x?5.8g
24x=585.8,解得x=2.4g,所以金属镁的质量分数=2.4g56.4g×100%=4.26%,
答:金属镁的质量分数为4.26%.
(3)金属镁不能和氢氧化钠反应,但是金属铝能反应,可以据此来设计实验,如:镁铝合金足量的氢氧化钠
本题解析:
本题难度:一般
4、简答题 某铝合金中含有镁、铜、硅,为了测定研究它的抗腐蚀性能和测定合金中铝的含量,某研究性学习小组设计了如下实验:
(一)探究铝合金的抗腐蚀性能
①向一只小烧杯里加入20mL0.5mol/LCuSO4溶液,把一小块铝合金浸入溶液中,1~2分钟后将铝片取出,观察铝片表面的现象
②取1只试管,加入10mL2mol/LNaOH溶液,将一块铝片放入NaOH溶液里,片刻取出后,用蒸馏水冲洗后浸入CuSO4溶液里.1~2分钟后将铝片取出,观察铝片表面的现象
实验①铝片没有变化,实验②铝片表面的现象是______
发生此现象的原因是______
(二)测定铝合金中的铝的百分含量
①取该样品a克,将样品溶于足量的稀盐酸中,过滤;
②在滤液中加入过量的氢氧化钠溶液,过滤;
③往第②步的滤液中通入足量的CO2,过滤,将沉淀用蒸馏水洗涤后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为b克.
回答下列问题:
(1)在第①步操作中溶解所使用的玻璃仪器为玻璃棒、______,滤液中主要含有Mg2+、Na+、______和Cl-离子;
(2)在第②步操作中氢氧化钠溶液需要过量的原因是______,写出该步骤中生成沉淀的离子方程式______
(3)第③步灼烧过程中可在下列哪种仪器中进行______
A.烧杯?B.试管?C.坩埚?D.蒸发皿
(4)第③步灼烧后得到的固体是______
(5)合金中铝的质量分数是______.
参考答案:(一)根据铝表面有一层致密的氧化物,该氧化物与CuSO4?溶液不反应,氢氧化钠溶液能除去表面的氧化膜:
Al2O3+2NaOH=NaAlO2+2H2O,内层的铝与硫酸铜发生置换反应生成金属铜:2Al+3CuSO4=Al2(SO4)3+3Cu,铜的颜色为红色;故答案为:铝片表面有亮红色的固体附着;因为铝片有一层致密的氧化物保护膜,可以阻止内部的金属铝与CuSO4反应,当铝片事先放入氢氧化钠溶液后,这层氧化膜被破坏,金属铝与硫酸铜发生置换反应生成了金属铜. (二)(1)因溶解需要的仪器有:烧杯、玻璃棒;将样品溶于足量的稀盐酸中,铜、硅与盐酸不反应,镁和铝与盐酸反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,过滤除去铜、硅,由于盐酸足量,所以,滤液中的成分为:
MgCl2、AlCl3、HCl,滤液中主要含有Mg2+、Na+、Al3+ 和Cl-离子;故答案为:烧杯;Al3+;?
(2)因过量的氢氧化钠溶液发生的反应有:HCl+NaOH=NaCl+H2O,2NaOH+MgCl2=Mg(OH)2↓+2NaCl,
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,实现了和 Mg(OH)2沉淀的分离,
故答案为:使Al3+全部变成AlO2-离子; Mg2++2OH-=Mg(OH)2↓;
(3)因灼烧过程中需要的仪器有:坩埚、坩埚?钳、酒精灯、泥三角、三脚架等,故答案为:C.
(4)因滤液中含有NaAlO2,通入足量的CO2发生反应:NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓,沉淀为Al(OH)3,灼烧时发生反应:2Al(OH)3?△?.?Al2O3+3H2O;故答案为:Al2O3; (5)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为
bg×27×227×2+16×3=54b102g,所以样品中铝的质量分数为:54b102gag×100%=54b102a×100%,
故答案为:54b102a×100%.
本题解析:
本题难度:一般
5、简答题 某实验室的废液中可能含有CuSO4、H2SO4、Na2SO4、NaCl、NaOH、Na2CO3和Ba(NO3)2中的一种或几种.某同学对其进行如下实验:
①取少许废液观察,为无色透明溶液
②向所取废液中滴加氯化钡溶液,有白色沉淀产生,再加入过量稀硝酸,无明显现象
③另取废液少许,向其中加入铁粉后,产生大量气泡根据以上现象可推断:废液中肯定含有______,肯定不含______不能确定是否含有______.
参考答案:该废液为无色溶液,所以一定没有氯化铜(氯化铜的溶液呈蓝色),滴加氯化钡溶液产生沉淀,继续加稀硝酸无明显现象,说明产生了硫酸钡沉淀,可知废液中一定含有硫酸根离子,向其中加入Fe粉后,产生大量气泡.说明溶液呈酸性,即一定含有硫酸,而原溶液为无色溶液,无浑浊,所以废液中物质相互间不发生化学反应,由于硫酸能与硝酸钡反应生成硫酸钡的沉淀,也能与碳酸钠反应生成二氧化碳气体,还能与氢氧化钠发生中和反应,故一定无硝酸钡、碳酸钠和氢氧化钠,而氯化钠和硫酸钠的存在与否,不影响题中的现象,故可能存在的是NaCl,Na2SO4;发生的化学反应主要有:H2SO4+BaCl2=BaSO4↓+2HCl;Fe+H2SO4=FeSO4+H2↑
故答案为:H2SO4;CuSO4、NaOH、Na2CO3和Ba(NO3)2;NaCl、Na2SO4;
本题解析:
本题难度:一般