|
高考化学知识点整理《氧化性和还原性强弱的比较》高频考点巩固(2019年模拟版)(二)
2020-07-08 01:15:39
【 大 中 小】
|
1、选择题 向含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中错误的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
|
参考答案:B
本题解析:A、x=0.4a,则氯气不足,只与亚铁离子反应,离子方程式正确;B、x=0.6a,其中0.5a与亚铁离子反应,剩余0.1a与溴离子反应,消耗溴离子的物质的量是0.2a,所以离子方程式中亚铁离子与溴离子的系数比是a:0.2a=5:1,该离子方程式缺少亚铁离子的反应,错误;C、x=a,则amol亚铁离子消耗氯气0.5a,剩余0.5a与溴离子反应,消耗溴离子amol,则离子方程式中亚铁离子、溴离子、氯气的物质的量比是1:1:1,正确;D、若x=1.5a,则氯气与溴化亚铁恰好反应,离子方程式正确,答案选B。
考点:考查量不同的离子方程式书写的判断
本题难度:困难
2、选择题 已知反应:①Cl2+2KI=I2+2KCl?②I2+KClO3=Cl2+2KIO3,下列说法中正确的是( )
A.①属于置换反应,②不属于置换反应
B.①中的I2是氧化产物,②中的Cl2是还原产物
C.反应①说明KI的氧化性比KCl强
D.反应②说明I2的氧化性比Cl2强
参考答案:A、两个反应均是一种单质和一种化合物反应生成新的单质和化合物的反应,属于置换反应,故A正确;
B、反应Cl2+2KI=I2+2KCl中,碘元素化合价升高,被氧化,得到氧化产物I2,反应I2+KClO3=Cl2+2KIO3中氯元素化合价降低,被还原,得到还原产物Cl2,故B正确;
C、反应①中氧化剂是Cl2,氧化性强于氧化产物I2的氧化性,故C错误;
D、反应②中还原剂I2的还原性强于还原产物Cl2的还原性,故D错误.
故选AB.
本题解析:
本题难度:简单
3、选择题 向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
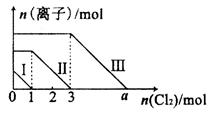
A.线段III代表Fe2+的变化情况
B.线段I代表Br-的变化情况
C.a值等于6
D.原混合溶液中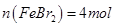
参考答案:C
本题解析:还原性强弱顺序:I?>Fe3+>Br?,所以首先反应Ⅰ表示I?,Ⅱ表示Fe2+,Ⅲ表示Br?,A、B项错;根据图像可知与I?反应的Cl2为1mol,则I?为2mol,与Fe2+反应的Cl2为2mol,则Fe2+为4mol,所以FeI2为1mol,FeBr2为3mol,Br?为6mol,氧化Br?的Cl2为3mol,可得a=6。
本题难度:一般
4、选择题 已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G
参考答案:
本题解析:
本题难度:一般
5、简答题 请按要求完成下面各小题.
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流.下列有关实验过程中,一般不需要使用玻璃棒进行操作的是______
①用pH试纸测定NaHCO3溶液的pH
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑦探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化
Ⅱ.设计简单实验证明:氧化性Cl2>FeCl3>KI.简述实验步骤、现象和结论.
可供选用的试剂有:氯水、氯化铁溶液、碘水、氢氧化钠溶液、稀硫酸、硫氰化钾溶液、碘化钾淀粉溶液、氯化亚铁溶液、过氧化氢溶液、蒸馏水;仪器为中学化学实验常用仪器,自选.______
Ⅲ.实验室用表面带有少量铁锈(Fe2O3?xH2O)的铁屑制取绿矾(FeSO4?7H2O).
①实验中应控制药品量的使用,应使______(填名称)稍过量.
②制备过程中有关反应的化学方程式:______
③反应结束后精制绿矾,精制过程中需将溶液加热至50℃~80℃.为减少过滤时绿矾的损失,应将溶液______.
参考答案:Ⅰ.①用pH试纸测定NaHCO3溶液的pH,用玻璃棒蘸取少许待测液于试纸的中部,故①错误;
②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl,先将固体溶于水,用玻璃棒搅拌,过滤,用玻璃棒引流,再将滤液加热蒸发得到KCl,用玻璃棒搅拌和转移,故②错误;
③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀,将吸有NaOH溶液的滴管插入液面以下,无需玻璃棒,故③正确;
④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验,通过滴定管进行滴定,无需玻璃棒,故④正确;
⑤将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体,加热直到液体变为红褐色停止加热,无需玻璃棒,故⑤正确;
⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验,滴入浓硫酸时要用玻璃棒不断搅拌,故⑥错误;
⑦探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化,用玻璃棒搅拌两固体的混合物,故⑦错误;
故选:③④⑤;
Ⅱ.因证明氧化性:Cl2>FeCl3>KI,即证明发生了反应:Cl2+2FeCl2═2FeCl3,2FeCl3+2KI═2FeCl2+2KCl+I2,同时证明有新物质(指定)生成,故答案为:①取FeCl2溶液少许,加入KSCN溶液,无明显现象,加氯水少许,变为血红色溶液,说明氧化性Cl2>FeCl3;②取无色的碘化钾淀粉溶液,加入FeCl3溶液,变蓝色,说明氧化性FeCl3>KI.
Ⅲ.①为了使Fe2(SO4)3全部转化为FeSO4,铁屑应过量,故答案为:铁屑;
②废铁屑中有铁、氧化铁,铁与稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水,铁还能与硫酸铁反应生成硫酸亚铁,方程式为:Fe+H2SO4═FeSO4+H2↑、3H2SO4+Fe2O3?xH2O═Fe2(SO4)3+(3+x)H2O、Fe2(SO4)3+Fe═3FeSO4,故答案为:Fe+H2SO4═FeSO4+H2↑、3H2SO4+Fe2O3?xH2O═Fe2(SO4)3+(3+x)H2O、Fe2(SO4)3+Fe═3FeSO4;
③趁热过滤可以减少绿矾的损失,故答案为:趁热过滤.
本题解析:
本题难度:一般
|