|
高中化学知识点总结《原电池原理》考点巩固(2019年最新版)(二)
2020-07-08 01:16:21
【 大 中 小】
|
1、选择题 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开Kv,闭合Ke一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开Ke,闭合Kv,观察到电流计A的指针有偏转.下列说法不正确的是( )
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2
C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑十2H2O
D.断开K1,闭合K2时,OH-向b极移动
| 
参考答案:A、断开K3,闭合K1时,相当于电解装置,相当于电解氢氧化钾,实质是电解水,所以氢氧化钾的浓度增大,pH要变大,故A正确;
B、断开K1,闭合K3时,形成氢氧燃料电池,在a极附近有大量的氧气,在b极附近有大量的氢气,此时b极是负极,发生失电子的氧化反应,在碱性电解质下,电极反应为:3OH-+H3-3如-═3H3O,故B错误;
C、断开K3,闭合K1时,形成电解池,a极是阳极,氢氧根离子发生失电子的氧化反应,即4OH--4如-═O3↑33H3O,故C正确;
D、断开K1,闭合K3时,形成氢氧燃料电池,a极是充满氧气的正极,b极是充满氢气的负极,电解质里的阴离子移向电池的负极移动,即OH-向b极移动,故D正确.
故选B.
本题解析:
本题难度:一般
2、选择题 控制适合的条件,将反应2Fe3++2I-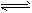 2Fe2+ +I2设计成如下图所示的原电池。下列判断不正确的是 2Fe2+ +I2设计成如下图所示的原电池。下列判断不正确的是

[? ]
A.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.反应开始时,乙中石墨电极上发生氧化反应
参考答案:A
本题解析:
本题难度:一般
3、选择题 某蓄电池充放电时的反应如下:

有下列推断,其中正确的是:①放电时铁极为正极,Ni2O3为负极 ②充电时阴极上的电极反应式是Fe(OH)2+2e=Fe+2OH-?③充电时,Ni(OH)2为阳极?④蓄电池的电极必须浸在某种碱性电解质溶液中
A.②③④
B.①③④
C.①②④
D.①②③
参考答案:A
本题解析:各种蓄电池及可充电电池都是可逆电池,放电时发生原电池反应,充电时发生电解反应,方程式左、右互为反应物和生成物。
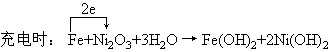
Fe为负极:Fe-2e+2H2O=Fe(OH)2+2H+
正极反应:Ni2O3+2e+3H2O=2Ni(OH)2+2OH-
两电极反应的加合,即为电池反应。
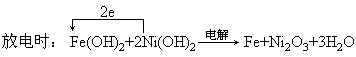
阳极(氧化):2Ni(OH)2-2e+2OH-=Ni2O3+3H2O
阴极(还原):Fe(OH)2+2e=Fe+2OH-
两式相加即为电解(充电)总反应。由以上两种过程可以看出,反应是在碱性环境中进行的。故正确的推断为A。
本题难度:一般
4、选择题 下列关于如图所示装置的叙述中正确的是( )

A.可将电能转化为化学能
B.铜是正极,铜片上有气泡产生
C.电流从锌片经导线流向铜片
D.氢离子在锌片表面被还原
参考答案:A.如图装置为原电池装置,将化学能转化为电能,故A错误;
B.电池工作时,活泼金属Zn为负极,失电子被氧化,铜为正极,氢离子在正极得电子被还原生成氢气,有气泡,故B正确;
C.电流由正极(Cu)经导线流向负极(Zn),故C错误;
D.氢离子在正极(Cu)得电子被还原生成氢气,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 直接提供电能的反应一般是放热反应,下列反应中能直接提供电能的是(?)
A.Ba(OH)2·8H2O与NH4Cl反应
B.氢氧化钠与稀盐酸反应
C.灼热的炭与CO2反应
D.H2与O2的反应
参考答案:D
本题解析:一般氧化还原反应才能设计成原电池,提供电能。据此可知选项AB不正确,二者都是非氧化还原反应,C是氧化还原反应,但是吸热反应,答案选D。
点评:该题是中等难度的试题,侧重对学生基础知识的巩固和检验,难度不大。该题的关键是明确常见的放热反应和吸热反应,以及氧化还原反应的判断,有利于培养学生的逻辑推理能力。
本题难度:简单
| 