1、选择题 只用一种试剂就可以鉴别NaHCO3、Na2S2O3、K2SO3、Na2SiO3、KCl、K2S六种无色溶液,这种试剂是( )
A.NaOH溶液
B.硝酸
C.澄清的石灰水
D.盐酸
参考答案:A.加入NaOH溶液,与NaHCO3反应没有明显的现象,与其它物质都不反应,无法鉴别,故A错误;
B.加入硝酸,发生氧化还原反应,无法鉴别Na2S2O3与K2SO3或Na2S2O3与K2S,现象相同,故B错误;
C.加入澄清石灰水,K2S、K2SO3、Na2SiO3等都产生沉淀,不能鉴别出,故C错误;
D.加入盐酸,NaHCO3生成无色无味气体,Na2S2O3生成淡黄色沉淀和刺激性气体,K2SO3生成刺激性气体,Na2SiO3生成沉淀,KCl无现象,K2S生成臭鸡蛋气味的气体,现象各不相同,可鉴别,故D正确.
故选D.
本题解析:
本题难度:一般
2、实验题 某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大 C.生成物的催化作用 D.反应物接触面积增大
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表
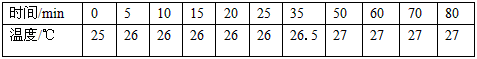
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整
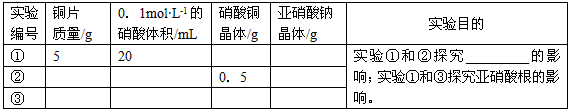
参考答案:(1)3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
(2)AC
(3)温度不是反应速率明显加快的主要原因(4)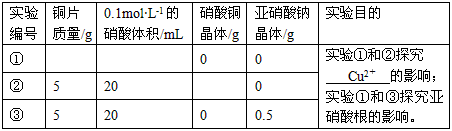
本题解析:
本题难度:一般
3、实验题 (15分)
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。
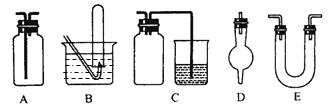
请回答下列问题:
⑴能用作干燥氨气的装置有___________(填字母);
⑵既能用于收集氯气又能用于收集一氧化氮气体的装置有____________(填字母);
⑶在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有____________(填字母);
⑷能用于乙烯与溴水反应制二溴乙烷的实验装置有_____________(填字母);
⑸若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是________________________________________________________________。
⑹为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
①可通过观察?现象来定性比较得出
结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是?;
你认为还可以作何改进?
?﹒
参考答案:⑴ E(2分)?⑵AB(2分)?⑶.A(2分)?⑷A(2分)?⑸.可防止倒吸(2分)
(6)①反应产生气泡快慢或反应完成的先后或试管壁的冷热程度。(2分)
②控制阴离子相同,排除阴离子的干扰。(2分) 将FeCl3改为Fe2(SO4)3。(1分)
本题解析:略
本题难度:一般
4、实验题 为了探究铁与氯气在一定条件下反应后的固体中铁元素的价态,化学兴趣小组的甲、乙、丙三同学分别进行了如下实验。
(1)甲取少许反应后的固体,加入适量稀硝酸,在所得溶液中滴加KSCN溶液出现血红色,则此时溶液显血红色的离子方程式为_______________________________________。该同学由此得出铁与氯气的反应产物中含有+3价铁的结论。请指出该结论是否合理并说明理由_________________________________________________________。
(2)乙取少许反应后的固体,加入盐酸,溶解、过滤,向滤液中滴加KSCN溶液,溶液呈无色。乙由此得出铁与氯气的反应产物中含有+2价铁的结论。请指出该结论是否合理并说明理由
____________________________________________________________。
(3)丙取11.2g铁粉与氯气反应,将反应后所得固体研碎分成两等份,其中一份用磁铁吸引,吸出的固体质量为1.4g;另一份用水完全溶解后加入足量的硝酸银溶液,所得白色沉淀经洗涤干燥后称重为32.29g。根据以上数据确定反应产物中铁元素的价态是____________(写出计算和推理过程)。
参考答案:(1)Fe3+ + 3SCN- = Fe(SCN)3?不合理。稀硝酸有强氧化性,若铁为+2价,则被氧化为+3价同样可使溶液变成血红色
(2)不合理。若铁为+3价、铁粉过量,则过量的铁可以将Fe3+还原成Fe2+
(3)+3。因n(Fe) = (5.6-1.4) /56 =" 0.075" mol,n(Cl) =" 32.29/143.5" =" 0.225" mol,所以n(Fe) / n(Cl) =" 1/3" ,则反应产物中只有+3价铁
本题解析:略
本题难度:简单
5、实验题 “套管实验”具有装置简洁便利等优点,结合下面的图示回答有关问题。

(1)欲利用图A比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物,最好应在大试管内底部加入 ____(填化学式),石灰水变浑浊的烧杯是 ___(填“甲”或“乙”)。
(2)欲利用图B验证铜与浓硝酸的反应产物,该装置除简洁外,你认为最明显的一个优点是___。
(3)用锌粒和稀硫酸用图C仪器制取并收集一试管氢气,锌粒和稀硫酸应放在____(填“大”或 “小”)试管中组成发生装置,理由是____, 该反应的离子方程式为____。
参考答案:(1) Na2CO3 ;乙
(2)污染物未排入大气,便于控制 反应的进行与停止
(3)小 ;便于收集H2 ;Zn+ 2H+=Zn2++H2↑
本题解析:
本题难度:一般