1、实验题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置如图,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
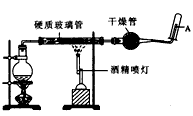
(1)写出该反应的方程式;___________________,该反应中的还原剂是 _________,氧化剂是___________。
(2)实验前必须对整套装置进行气密性检查,检查方法是 _________________。
(3)圆底烧瓶中装有水,该装置的主要作用是____________;烧瓶底部放置几片碎瓷片,其作用是__________。
(4)酒精灯和酒精喷灯点燃的顺序是____________,理由是 ______________________。
(5)干燥管中的物质是_______________,作用是_____________。
(6)试管中收集的气体是______________,如果要在A导管口点燃气体,之前必须___________,方法是________________,目的是_____________。
参考答案:(1) ;Fe;H2O
;Fe;H2O
(2)在玻璃管口A处接一乳胶管,乳胶管上连一玻璃管,并将管口浸没水中,用酒精灯微热烧瓶底部,如果观察到水中的玻璃管口有气体逸出,停止加热后,玻璃管内有一段水柱,且较长时间水柱不回落,则标明装置气密性良好。
(3)为Fe与水蒸气的反应提供水蒸气防止暴沸
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯防止先点燃酒精喷灯导致Fe与O2反应
(5)碱石灰等除去H2中的水蒸气
(6)H2验纯用试管收集一试管气体,靠近酒精灯火焰点燃,如果发出爆鸣声,则证明收集的氢气不纯,如果是较轻的“噗”声,则证明氢气较纯净防止氢气中混有氧气,点燃时爆炸
本题解析:
本题难度:一般
2、实验题 某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾实验中起催化作用。装置如图

实验步骤如下:
①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为bg;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气。
请回答下列问题:
(1)上述各步骤操作中,需要用到玻璃棒的是__________(填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为____________ ×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应 该进行的实验操作是____(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
参考答案:(1)①②③ (2) (3)cadbe
(3)cadbe
(4)直接加热氯酸钾,观察生成氧气的快慢
本题解析:
本题难度:一般
3、实验题 (8分)(2011·西宁模拟)甲醛是世界卫生组织(WHO)确认的致癌物质和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组打算利用酸性KMnO4溶液测定新装修房屋内的空气中甲醛的含量,请你参与并协助他们完成相关的学习任务。
测定原理:
酸性KMnO4为强氧化剂,可氧化甲醛和草酸,其反应方程式如下所示:
4MnO4-+5HCHO+12H+===4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
测定装置:
部分装置如下图所示:

测定步骤:
(1)用______________量取5.00 mL 1.00×10-3mol·L-1KMnO4溶液,注入洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释,备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
(3)打开a,关闭b,用注射器抽取100 mL新装修房屋内的空气。关闭________,打开________(填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
(4)将洗气瓶中的溶液转移到锥形瓶中(包括洗涤液),再用草酸标准溶液进行滴定,记录滴定所消耗的草酸标准溶液的体积。
(5)再重复实验2次(每次所取的高锰酸钾溶液的体积均为5.00 mL)。3次实验所消耗的草酸标准溶液的体积平均值为12.38 mL。
交流讨论:
(1)计算该新装修房屋内的空气中甲醛的浓度为________mg·m-3,该新装修房屋内的甲醛________(填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设:______________、______________(至少答出两种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
实验中可不用草酸标准溶液滴定,可多次直接抽取新装修房屋内的空气,再推送到洗气瓶中,直至_________________________________________________________;
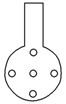
②实验装置应加以改进
可将插入酸性KMnO4溶液中的导管下端改成具有多孔的球泡(如图所示),有利于提高实验的准确度,其理由是___________________________________________________。
参考答案:测定步骤:(1)酸式滴定管"(3)a"b
交流讨论:(1)3.6"是
(2)注射器推送气体速度过快"装置气密性较差"同一地点取样次数太多等(任选其中两个作答或其他合理答案均可)
(3)①酸性KMnO4溶液刚好褪色"②可增大气体与溶液的接触面积,使空气中的甲醛被充分吸收
本题解析:本题考查了氧化还原滴定的计算,核心内容是得失电子守恒。实验的基本原理:先用过量的酸性高锰酸钾将甲醛氧化成CO2,然后用草酸还原剩余的酸性高锰酸钾。根据题目信息可知实验总共消耗含甲醛的空气体积为5×100 mL=0.5 L=0.0005 m3;
设0.5 L空气中甲醛的物质的量为x,则:
4x/5+0.01238 L×1.00×10-3 mol·L-1×2/5=5.00×10-3 L×1.00×10-3 mol·L-1
解得x=6.0×10-8mol
甲醛的质量:6.0×10-8mol×30000 mg·mol-1=1.8×10-3 mg
甲醛的浓度:1.8×10-3 mg÷0.0005 m3=3.6 mg·m-3。故新装修房屋内的甲醛超标。
本题难度:一般
4、实验题 (15分)乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 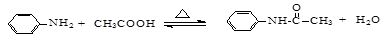
实验参数:
名称
| 式量
| 性状
| 密度/g/cm3
| 沸点/℃
| 溶解度
|
苯?胺
| 93
| 无色油状液体,
具有还原性
| 1.02
| 184.4
| 微溶于水
| 易溶于乙醇、乙醚等
|
乙?酸
| 60
| 无色液体
| 1.05
| 118.1
| 易溶于水
| 易溶于乙醇、乙醚
|
乙酰苯胺
| 135
| 白色晶体
| 1.22
| 304
| 微溶于冷水,溶于热水
| 易溶于乙醇、乙醚
|
实验装置:(见右图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:?
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,
调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是???
(2)为何要控制分馏柱上端的温度在105?C左右???
(3)通过什么现象可判断反应基本完成???
(4)步聚1加热可用???(填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是?。
(5)洗涤乙酰苯胺粗品最合适的试剂是 ???。
A. 用少量冷水洗? B. 用少量热水洗
C. 先用冷水洗,再用热水洗?D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是?。
参考答案:(1)防止苯胺在反应过程中被氧化;
(2)不断分出反应过程中生成的水,促进反应正向进行
(3)温度计温度下降或锥形瓶内液体不再增加;
(4)油浴;用玻璃棒摩擦容器内壁(或投入晶种或用冰水冷却);
(5)A?;(6)60%
本题解析:(1)苯胺不稳定,容易内空气中的氧气氧化为硝基苯,为防止苯胺在反应过程中被氧化;加入还原剂Zn粉。(2)水的沸点是100℃,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率。(3)若看到温度计温度下降或锥形瓶内液体不再增加就表面反应物的蒸气较少,生成物达到了最大量,反应基本完成;(4)(4)由于步聚1加热的温度在105℃左右,而沸腾的水温度为100℃,不能达到该温度,所以步骤1可用油浴加热的方法。步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是用玻璃棒摩擦容器内壁(或投入晶种或用冰水冷却)的方法实现结晶;(5)由于乙酰苯胺微溶于冷水,溶于热水,所以洗涤粗品最合适的试剂是用少量冷水洗,以减少因洗涤造成的损耗。故选项为A。(6)n(苯胺)=" (9.1mL" ×1.02g/ml)÷93g/mol=0.1mol;n(乙酸)=( 17.4mL ×1.05g/ml)÷60g/mol=0.305mol。大于苯胺的物质的量,所以产生乙酰苯胺的物质的量要以不足量的苯胺为原料为标准。理论产量为0.1mol,而实际产量n(乙酰苯胺)= 8.1g÷135g/mol=0.06mol。所以乙酰苯胺的产率为0.06mol÷0.1mol×100%=60%。
本题难度:一般
5、选择题 下列有关实验原理、方法和结论都正确的是:
A.某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I-
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,
说明X溶液中一定含有Fe2+
C.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,
则说明原溶液中一定含SO42—
D.某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+
参考答案:A
本题解析:A、萃取过程,正确;
B、可能原溶液中有Fe3+;
C、硝酸具有强氧化性,原溶液中有亚硫酸根可能被氧化为硫酸根;
D、需要透过蓝的钴玻璃才能看出比较明显的紫色。
本题难度:简单