1、实验题 (10分)氯气是一种化学性质活泼的气体。
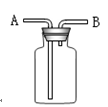
⑴氯气是一种具有?气味的气体,密度比空气的?(填“大”或“小”),若采用图中装置收集氯气,则氯气应由?管(填“A”或“B”)通入
⑵氯气与NaOH溶液反应的化学方程式为?,该反应可用于工业上制取漂白液,其有效成分是?。
参考答案:(1)刺激性?大? A
(2)Cl2 + 2NaOH ="NaCl" + NaClO + H2O? NaClO
本题解析:考查氯气的性质及收集
(1)氯气是一具有刺激性气体的有毒气体,式量远大于空气,密度比空气大,故可采用向上排空气法来收集,所以应该长管进,短管出
(2)Cl2 + 2NaOH ="NaCl" + NaClO + H2O
+1价氯元素有强氧化性漂白性,故NaClO为漂白液的有效成份
本题难度:一般
2、简答题 根据如图回答问题:
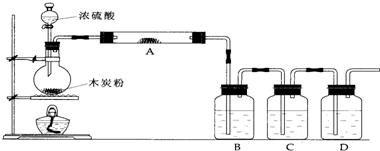
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.
答:______
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:______
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是______,作用是______.
B中加入的试剂是______,作用是______.
C中加入的试剂是______,作用是除尽______气体.
D中加入的试剂是______,作用是______.
(4)实验时,C中应观察到的现象是______.
参考答案:(1)由于装置较大,用手捂的方法难以观察到明显现象,可在反应前点燃酒精灯,加热烧瓶一小会儿.在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气,
故答案为:反应前点燃酒精灯,加热烧瓶一小会儿.在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气;
(2)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,反应的方程式为2H2SO4(浓)+C△.CO2↑+2SO2↑+2H2O,
故答案为:2H2SO4(浓)+C△.CO2↑+2SO2↑+2H2O;
(3)浓硫酸和木炭粉在加热条件下反应生成二氧化碳和二氧化硫气体,同时生成水,可先用无水硫酸铜检验水,然后用品红检验二氧化硫,用酸性高锰酸钾除去二氧化硫,可用澄清石灰水检验二氧化碳气体,则A中加入无水硫酸铜,目的是检验 H2O,B中加入品红溶液,目的是检验 SO2,C中加入足量酸性KMnO4 溶液,目的是除去SO2,D中加入澄清石灰水,目的是检验CO2,
故答案为:无水硫酸铜;检验H2O;
品红溶液;检验SO2;
足量酸性KMnO4溶液;SO2;
澄清石灰水;检验CO2;
(4)二氧化碳不溶液酸性高锰酸钾,二氧化硫与酸性高锰酸钾发生氧化还原反应,可被还原生成二氧化锰,则可观察到导管有气泡冒出,溶液紫色逐渐变浅,瓶底有少量黑色固体生成,
故答案为:导管有气泡冒出,溶液紫色逐渐变浅,瓶底有少量黑色固体生成.
本题解析:
本题难度:一般
3、实验题 如图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
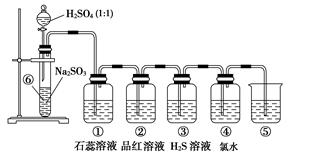
(1)⑥中发生的化学反应方程式为______________________________________(2分)
(2)⑤的作用是_______________________________________________________(2分),
反应的离子方程式为___________________________________________________(2分)
(3)填表格(每空1分)
装置
| 实验现象
| 体现SO2的性质
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
|
④
| ?
| ?
参考答案:(1)Na2SO3+H2SO4===Na2SO4+H2O+SO2↑(2分)
(2)吸收过量的SO2,防止污染环境?SO2+2OH-===SO+H2O(2分)
(3)( 每空1分)
装置
实验现象
体现SO2的性质
①
溶液变红色
SO2水溶液显酸性
②
溶液退色
漂白性
③
溶液变浑浊
氧化性
④
氯水退色
还原性
本题解析:(1)硫酸和亚硫酸钠反应生成SO2,则⑥中发生的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(2)SO2是大气污染物,因此氢氧化钠溶液的作用是吸收过量的SO2,防止污染环境,反应的离子方程式为SO2+2OH-=SO+H2O。
(3)SO2是酸性氧化物,溶于水显酸性,石蕊试液变红色;SO2具有漂泊性,能使品红溶液褪色;SO2具有氧化性,能把H2S氧化生成单质S沉淀;另外SO2还具有还原性,能被氯水氧化,使氯水褪色。2的制备、SO2性质的检验以及尾气处理
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
4、实验题 已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:
MnO2+4HCl(浓)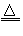 MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题 MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
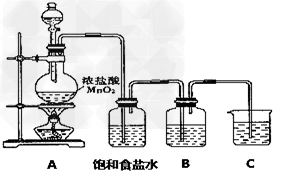
(1)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-还原性强;④HCl比H2S稳定;⑤硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可作为氯元素比硫元素非金属性强的依据的是________。
A.②④?B.②③④⑤?C.②④⑤?D.全部
(2)装有饱和食盐水的洗气瓶的作用是________________
(3)装置B中盛放的试剂是________(填选项),实验现象为_____________?。
A.Na2S溶液?B.Na2SO3溶液?C.Na2SO4溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。
参考答案:(1)B
(2)为了除去气体中的HCl
(3)A;生成淡黄色沉淀或溶液变浑浊
(4)0.02
(5)Cl2 +2OH-=Cl-+ClO-+H2O
本题解析:
本题难度:一般
5、实验题 某课外小组同学对不同条件下铁钉的锈蚀进行了实验,并于一周后观察。

(1)铁钉被腐蚀程度最大的是____(填实验序号)。
(2)实验③中主要发生的是____(填“化学腐蚀”或“电化学腐蚀”)。
(3)根据上述实验,你认为铁发生电化学腐蚀的条件是____。 实验④中正极的电极反应式为________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防止金属被腐蚀可 采取的措施是____(至少写两种)。
参考答案:(1)④
(2)电化学腐蚀
(3)铁与电解质溶液接触、与潮湿空气接触; O2+2H2O+4e-==4OH-
(4)定期涂防锈漆;改变金属内部结构制成不锈钢、其他合金;保持环境的干燥等
本题解析:
本题难度:一般
|