1、选择题 见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是?

A.浓H2SO4? B.NaOH溶液? C.水? D.饱和食盐水
参考答案:B
本题解析:略
本题难度:一般
2、选择题 某温度下,将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液.经测定ClO-与ClO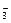 的物质的量浓度之比是1:2,则Cl2与KOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是
的物质的量浓度之比是1:2,则Cl2与KOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是
A.2:3
B.4:3
C.10:3
D.11:3
参考答案:D
本题解析:由已知条件及质量守恒定律写出方程式:
7Cl2+14KOH====11KCl+KClO+2KClO3+7H2O
被氧化的氯为3 mol,被还原的氯为11 mol.即知被还原的氯元素与被氧化的氯元素的物质的量之比为11:3.
本题难度:简单
3、选择题 如图,某同学将KClO3、浓盐酸、镁粉装进试管中,塞好胶塞,片刻后在管外点燃镁条,产生耀眼的白光,立即发现胶塞剧烈冲出。该同学的实验目的是

A.制取氢气并检验其纯度
B.制取氯气并检验其纯度
C.验证氯酸钾的氧化性
D.验证光对氢气和氯气反应的作用
参考答案:D
本题解析:略
本题难度:一般
4、计算题 将由CaCO3、MgCO3组成的混合物充分加热至质量不再减少时,称得残留物的质量为原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是多少?
参考答案:Ca、Mg两元素原子的物质的量之比为1:3.
本题解析:将CaCO3、MgCO3混合物加热时,发生反应:
CaCO3 CaO+CO2↑ MgCO3
CaO+CO2↑ MgCO3 MgO+CO2↑
MgO+CO2↑
则有:n(CaCO3)=n(CaO)?n(MgCO3)=n(MgO)
100 g·mol-1×n(CaO)+84 g·mol-1×n(MgO)=2×[56 g·mol-1×n(CaO)+40 g·mol-1×n(MgO)]
n(CaO):n(MgO)=1:3,所以N(Ca):N(Mg)=1:3.
本题难度:一般
5、选择题 下列现象或事实可用同一原理解释的是( )
A.氯水和活性炭都能使红墨水褪色
B.二氧化硫和二氧化碳都能使紫色石蕊溶液变红
C.二氧化硫和氯水都能使品红溶液褪色
D.浓硫酸和浓盐酸长期暴露在空气中浓度都降低
参考答案:A.氯水和活性炭都能使红墨水褪色,但原理不同,其中氯水中含有次氯酸,具有漂白性,而活性炭因具有吸附性而使溶液褪色,故A错误;
B.二氧化硫和二氧化碳都为酸性气体,可与水反应生成酸,都能使紫色石蕊溶液变红,原理相同,故B正确;
C.二氧化硫与有色物质发生化合反应而使有色物质褪色,而氯气中含有具有强氧化性的次氯酸而使有色物质褪色,二者原理不同,故C错误;
D.浓硫酸具有吸水性,浓盐酸易挥发,二者在空气中浓度降低的原理不同,故D错误.
故选B.
本题解析:
本题难度:简单