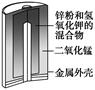
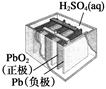
1、选择题 有关下列四个常用电化学装置的叙述中,正确的是(?)
| 
| 
| 
|
图Ⅰ 碱性
锌锰电池
| 图Ⅱ 铅?硫
酸蓄电池
| 图Ⅲ 电解
精炼铜
| 图Ⅳ 银锌
纽扣电池
|
?
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
参考答案:D
本题解析:A项,在干电池中MnO2作氧化剂,错误;B项,在铅蓄电池放电过程中,H2SO4的浓度不断减小,错误;C项,电解精炼铜时,电解质溶液中Cu2+的浓度减小,错误;D项正确。
本题难度:一般
2、选择题 关于如图所示装置的叙述,正确的是?

[? ]
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.铜离子在铜片表面被还原
参考答案:D
本题解析:
本题难度:一般
3、选择题 把a、b、c、d四块金属分别用导线两两相连浸入稀硫酸中组成原电池。若a、b 相连时a为负极;c、d相连时电流方向由d到c;a、c相连时c极上产生大量气泡;b、d相连时b极发生氧化反应,由此判断四种金属的活动性顺序由强到弱为 (? )
A.a>b>c>d
B.b>d>c>a
C.c>a>b>d
D.a>c>d>b ?
参考答案:D
本题解析:考查原电池的应用。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。据此可以判断四种金属的活动性顺序由强到弱为a>c>d>b,所以正确的答案选D。
本题难度:一般
4、选择题 用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
A.当电池负极消耗m g气体时,电解池阴极同时有m g气体生成
B.电池的正极反应式为:O2+2H2O+4e-=4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
参考答案:D
本题解析:氢氧燃料电池负极反应为2H2+4OH--4e-=4H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为2H2+O2=2H2O,n(KOH)不变,c(KOH)变小;电解Na2CO3溶液实质是电解水,阴极反应为4H++4e-=2H2↑,由电子守恒知与电池负极消耗的H2的量相等,由于Na2CO3溶液是饱和的,水减少,溶液中会有晶体析出,但溶液的浓度不变,且温度不变,其pH不变。
本题难度:简单
5、选择题 有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是(?)?
A.D >C >A >B?B. D >A >B >C
C.D >B >A >C?D.B >A >D >C
参考答案:B
本题解析:原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属,据此可以解答。两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B;金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜。如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C,所以金属的活动性顺序为:D>A>B>C,故选B。
点评:该题是高考中的常见题型,属于中等难度的试题。有利于培养学生的逻辑推理能力和发散思维能力。答题时能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属最高价氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱,注意相关知识的积累和总结。
本题难度:简单