1、选择题 下列4种鉴别碳酸钠和碳酸氢钠的方法中,可靠性最差的是(? )
A.观察样品外观
B.在少量的样品中滴入几滴水
C.在饱和溶液中滴入几滴酚酞
D.取少量的试样加热
参考答案:A
本题解析:碳酸钠和碳酸氢钠外观很相似,不易鉴别。
本题难度:简单
2、选择题 在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到室温,下列说法正确的是
[? ]
A.溶液中Na+浓度增大,有H2放出
B.溶液中OH-浓度不变,有O2放出
C.溶液中Na+数目减少,有O2放出
D.溶液中OH-浓度增大,有O2放出
参考答案:BC
本题解析:
本题难度:一般
3、实验题 (12分)、过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下:? Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑  ?2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
?2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
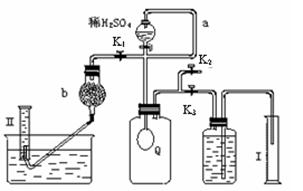
⑴Q内发生反应生成的气体为__________,导管a作用是 。
⑵为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3。当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________ _____,b中装的碱石灰的作用是_ _________________。
_________________。
⑶实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
⑷某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时 ,量筒液面高于水槽液面
,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积
参考答案:(12分)
⑴CO2、O2;平衡分液漏斗上、下的压强,使稀H2SO4顺利滴下。
⑵气球Q慢慢缩小,左侧导管有气泡生成。吸收二氧化碳。
⑶ [12200y/(53x-37y)]% (4)BC?(每空2分,共12分
本题解析:略
本题难度:一般
4、选择题 把适量Na2O2加入下列饱和溶液中,原溶液溶质的浓度基本不变的是
A.NaCl
B.Na2SO3
C.MgCl2
D.NaHCO3
参考答案:A
本题解析:过氧化钠溶于水生成氢氧化钠和氧气,同时过氧化钠还具有氧化性,所以B中生成硫酸钠,C中生成氢氧化镁白色沉淀,D中生成碳酸钠,即原溶液溶质的浓度减小,所以答案选A。
点评:该题容易错选B。这是由于过氧化钠溶于水后生成氢氧化钠,而都忽略了过氧化钠的重要性质还具有强氧化性导致的,所以做题还需要灵活运用知识解决实际问题,而不死记硬背,生搬硬套。
本题难度:一般
5、填空题 二元弱酸是分步电离的,25时碳酸和草酸的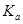 如下表:
如下表:
H2CO3
| Ka1=4.3×10-7
| H2C2O4
| Ka1=5.6×10-2
|
Ka2=5.6×10-11
| Ka2=5.42×10-5
|
?
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液? B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液? D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。
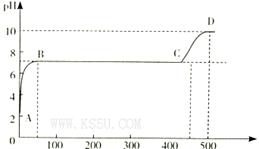
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
参考答案:(1)B ?C?(2)2H++CO32-=H2O+CO2↑? Ca2++CO32-=CaCO3↓? 10-4
本题解析:(1)因为H2C2O4的二级电离平衡常数Ka2=5.42×10-5> H2CO3的二级电离平衡常数Ka2=5.6×10-11。所以在这四种溶液c(H+)最大的是0.1 mol/L的NaHC2O4溶液。正确选项为B.电离平衡常数越小,其钠盐水解的程度就越大。溶液的碱性就越强。由于Ka2(H2C2O4)=5.42×10-5> 5.6×10-11= Ka2(H2CO3),所以c(OH-)最大的是0.1 mol/L的Na2CO3溶液。正确选项为C.(2)在反应开始时由于溶液的pH略大于2,说明溶液中含有过量稀盐酸电离产生大量的H+。此时滴入碳酸钠溶液时发生反应的离子方程式为2H++CO32-=H2O+CO2↑;在PH=7,溶液呈中性时发生的反应为CaCl2+Na2CO3="2NaCl+" CaCO3↓.反应的离子方程式为Ca2++CO32-=CaCO3↓。当该反应发生完全后继续加入Na2CO3,则是Na2CO3和NaCl的混合溶液。NaCl是强酸强碱盐,不发生水解反应,而Na2CO3是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,使溶液显碱性。在D点溶液的pH=10,则c(H+)=10-10mol/L.由于H+you 消耗,所以水电离产生的OH-的浓度为:c(OH-)=Kw÷c(H+)=10-4mol/L.所以c(H+)(水)= c(OH-)(水)= 10-4mol/L。+)、c(OH-)的比较及混合溶液中离子方程式的书写及盐水解时水电离产生的离子浓度的问题。
本题难度:一般