1、选择题 200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体密封冷却后加入含有Na+、HCO、SO、CO等离子的水溶液中,假设加入后溶液体积保持不变,则下列说法中正确的是
A.原混合气体中CO2和水蒸气各0.25mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.50 mol
C.溶液中SO的物质的量浓度基本保持不变
D.溶液中HCO的物质的量浓度减小,CO的物质的量浓度增大,但是HCO和CO的物质的量浓度之和基本保持不变
参考答案:B
本题解析:略
本题难度:一般
2、选择题 某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),则下列分析推理中不正确的是( )
?
| 50 mL盐酸
| 50 mL盐酸
| 50 mL盐酸
|
m(混合物)
| 9.2 g
| 15.7 g
| 27.6 g
|
V(CO2)(标准状况)
| 2.24 L
| 3.36 L
| 3.36 L
|
A.盐酸的物质的量浓度为3.0 mol·L-1
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
参考答案:D
本题解析:由表中数据得出第1组中盐酸过量,第2、3组中盐酸不足,全部与HCO3-反应放出CO2。c(HCl)==3 mol·L-1,A选项正确;由第1组数据列方程式可求出NaHCO3的质量分数,B选项正确,加入混合物9.2 g时盐酸过量,C项正确;13.8 g混合物恰好与盐酸完全反应,D项不正确。
本题难度:一般
3、填空题 (14分) 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。然后再将NaHCO3制成
Na2CO3。
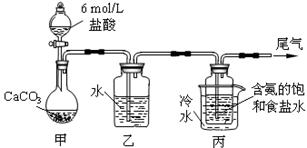
(1)装置乙的作用是?。为防止污染空气,尾气中含有的?需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有?、 ?、?。
NaHCO3转化为Na2CO3的化学方程式为?。
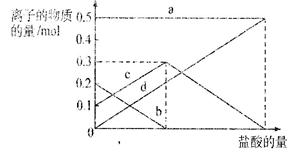
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如右图所示。
则曲线c对应的溶液中的离子是?
(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是?。
(4)若取21. 0 g NaHCO3固体,加热了t2?min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)。
参考答案:(1)除去二氧化碳中的氯化氢气体(2分)?氨气?(1分)
(2)过滤、洗涤、灼烧 (各1分)? 2NaHCO3 Na2CO3+H2O+CO2↑(2分)?
Na2CO3+H2O+CO2↑(2分)?
(3)HCO3-?(2分)? 1:2 (2分)?(4) 0.75 mol/L(2分)
本题解析:(1)装置甲是制备二氧化碳气体的反应装置,生成的二氧化碳气体中含有氯化氢气体,对制备碳酸氢钠有影响,装置乙的作用是吸收氯化氢气体;最后的尾气中含有氨气不能排放到空气中,需要进行尾气吸收;故答案为:吸收HCl;NH3;(2)由装置丙中产生的NaHCO3发生的反应为,NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;故答案为:过滤、洗涤、灼烧;(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g?完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-;? HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子浓度变化;碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L;样品中NaHCO3和Na2CO3的物质的量之比是1:2;故答案为:HCO3-; 1:2;(4)若取21g?NaHCO3固体物质的量为0.25mol ,加热了t2min后,剩余固体的质量为14.8g.依据化学方程式存在的质量变化计算: 2NaHCO3=Na2CO3+CO2↑+H2O△m
2?1? 62
0.2mol? 0.1mol? 21g-14.8g
反应后NaHCO3物质的量=0.25mol-0.2mol=0.05mol;NaHCO3+HCl=NaCl+H2O+CO2↑;消耗氯化氢物质的量0.05mol; Na2CO3物质的量=0.1mol,Na2CO3+2HCl=2NaCl+H2O+CO2↑,消耗氯化氢物质的量0.2mol;剩余氯化氢物质的量=0.200L×2mol/L-0.05mol-0.2mol=0.15mol,剩余溶液中c(H+)=0.75mol/L
本题难度:困难
4、选择题 将一定量的NaHCO3和Na2CO3的混合物加热到不再放出气体时,收集到CO2 aL,待冷却后。向残余物中加入足量盐酸又收集到CO22aL(体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为(?)
A.1∶1
B.1∶2
C.1∶3
D.1∶4
参考答案:B
本题解析:加热时碳酸氢钠分解生成碳酸钠和CO2以及水,反应的方程式是2NaHCO3 Na2CO3+H2O+CO2↑。碳酸钠和盐酸反应的方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑,其中和盐酸反应的碳酸钠包含碳酸氢钠分解生成的碳酸钠,所以根据CO2的体积可知混合物中Na2CO3和NaHCO3的物质的量之比为1∶2,答案选B。
Na2CO3+H2O+CO2↑。碳酸钠和盐酸反应的方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑,其中和盐酸反应的碳酸钠包含碳酸氢钠分解生成的碳酸钠,所以根据CO2的体积可知混合物中Na2CO3和NaHCO3的物质的量之比为1∶2,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的训练,有利于提高学生的逻辑推理能力。该题的关键是明确反应的原理,然后结合方程式灵活运用即可。
本题难度:简单
5、填空题 在1.00 L 1.00 mol·L-1 NaOH溶液中通入16.8 L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量分别为________。
参考答案:Na2CO3:0.250 mol? NaHCO3:0.500 mol
本题解析:通入CO2的物质的量=16.8 L/22.4 L·mol-1=0.750 mol
溶液中NaOH物质的量=1.00 L×1.00 mol·L-1=1.00 mol
根据2NaOH+CO2===Na2CO3+H2O
该反应中CO2过量:0.750 mol-1.00 mol/2=0.250 mol
生成的Na2CO3为1.00 mol/2=0.5 mol
Na2CO3+CO2+H2O===2NaHCO3
反应中Na2CO3过量,生成的NaHCO3为n(反应的CO2)×2=0.500 mol
溶液中剩余的Na2CO3为0.500 mol-0.250 mol=0.250 mol
本题难度:简单