1、选择题 下列有关实验的操作过程,正确的是( )
A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一粒钠小心放入装满水的烧杯中
B.配制100mL的质量分数10%的H2O2溶液:取一支规格为100mL的量筒,先取质量分数为30%的双氧水溶液33.3mL,然后于加水至100mL刻度线
C.检验某浅绿色溶液中含有Fe2+离子:取该溶液少许,向其中加入KSCN溶液,不变红色;再向其中滴加氯水,溶液变为红色
D.取出分液漏斗中所需的上层液体:当下层液体从分液漏斗下端管口流出后,及时关闭活塞,然后更换一个接收容器,打开活塞将分液漏斗中的液体放出
参考答案:A、在进行钠和水反应的实验时,将钠从煤油中取出后,要将表面的煤油擦干,否则会冒黑烟,故A错误;
B、百分含量是质量比,跟体积无关,因为密度随浓度变化而变化,所以稀释3倍的话可以取50克的双氧水加100克的水就变成原浓度的三分之一,也就是10%,如果取得是33.3毫升,30%的密度是1.11,所以实际的质量是33.3×1.11克,加水需要加66.6×1.11克(毫升)才能稀释到10%,而不是按照体积计算的,应该按照质量计算,故B错误;
C、取该溶液少许,向其中加入KSCN溶液,不变红色证明不含有三价铁,再向其中滴加氯水,溶液变为红色,证明是氯气将亚铁离子氧化为三价,一定含有亚铁离子,故C正确;
D、取出分液漏斗中的液体:下层液体从下口放出,上层液体从上口倒出,故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 把NaHCO3和Na2CO3·10H2O混和物6.56g溶于水制成100mL溶液,测得溶液中c(Na+)=0.5mol/L。向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为
A.2.93 g
B.5.85 g
C.6.56g
D.无法确定
参考答案:A
本题解析:NaHCO3和Na2CO3·10H2O混和物6.56g溶于水制成100mL溶液后,当加入一定量盐酸恰好完全反应溶液中的溶质为NaCL,由于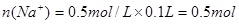 ,由钠离子守恒可得NaCL的物质的量为0.5mol,质量为2.93 g
,由钠离子守恒可得NaCL的物质的量为0.5mol,质量为2.93 g
本题难度:一般
3、实验题 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一是将HCO3-离子转化为沉淀并称重,则试剂A为______________(填化学式)溶液;操作2包括_______________________。
(2)方法二操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要___________________;操作2的名称是__________;该样品中NaHCO3的质量分数为_________(用含m、a的表达式表示)。
(3)根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是_______________;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。
(4)方法四的实验原理是________________(用化学方程式表示)。
参考答案:(9分)(1)Ba(OH)2[或Ca(OH)2];过滤、洗涤、干燥(有错不得分)
(2)100ml容量瓶、胶头滴管;中和滴定;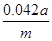 (或
(或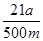 )
)
(3)m(CO2)(或实验前后干燥管的质量);空气中的二氧化碳、水蒸气等进入干燥管;装置中的二氧化碳没有完全排入干燥管
(4)2NaHCO3 Na2CO3+H2O+CO2↑(每空1分)
Na2CO3+H2O+CO2↑(每空1分)
本题解析:(1)要将HCO3-离子转化为沉淀并称重,则需要加入强碱氢氧化钡或氢氧化钙,化学式分别为Ba(OH)2或Ca(OH)2;不溶性物质从溶液中分离出的操作是过滤,所得的沉淀还需要经过洗涤并干燥后才能称量。
(2)要配制100ml待测液,则操作1中要用到的玻璃仪器除了有烧杯、玻璃棒外,还需要100ml容量瓶,以及定容时的胶头滴管。标准盐酸滴定碳酸氢钠溶液,所以操作2的名称是中和滴定;20ml待测液消耗盐酸的物质的量是a×10-4mol,则根据方程式NaHCO3+HCl=NaCl+H2O+CO2↑可知,原样品中碳酸氢钠的物质的量是a×10-4mol×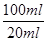 =5a×10-4mol,其质量=5a×10-4mol×84g/mol=0.042ag,所以该样品中NaHCO3的质量分数为
=5a×10-4mol,其质量=5a×10-4mol×84g/mol=0.042ag,所以该样品中NaHCO3的质量分数为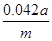 。
。
(3)碳酸氢钠与盐酸反应生成CO2,则通过计算CO2的质量即可以算出碳酸氢钠的含量,所以根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是m(CO2)或实验前后干燥管的质量;由于干燥管与大气相连,所以空气中的二氧化碳、水蒸气等进入干燥管,导致测量结果偏高;由于装置中的二氧化碳没有完全排入干燥管,还有残余,因此会导致测量结果偏低。
(4)由于碳酸氢钠不稳定,受热易分解生成碳酸钠、水和CO2,据此也可以测量碳酸氢钠的含量,所以方法四的实验原理是2NaHCO3 Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
本题难度:一般
4、填空题 (6分)化学提高了人们生存的质量,生活质量的提高又促进了化学发展。
(1)柠檬中富含钾、钠、钙、柠檬酸等,属于?性食品(填“酸性”或“碱性”);
(2)阿司匹林是人们熟知的治感冒药,具有解热镇痛作用。但长期大量使用会出现不良反应,如水杨酸反应。若出现水杨酸反应,应立即停药,并静脉滴注?溶液。
(3)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离子方程式:
? ?、?。
?、?。
参考答案:酸? NaHC O3?MgCO3+2H+ = Mg2
O3?MgCO3+2H+ = Mg2 ++CO2?+H2O↑? Al(OH)3+3H+=Al3++3H2O
++CO2?+H2O↑? Al(OH)3+3H+=Al3++3H2O
本题解析:略
本题难度:一般
5、选择题 下列各组物质混合后,不能生成NaOH的是
A.Na和H2O
B.Na2O2和H2O
C.Ca(OH)2溶液和Na2CO3溶液
D.Ca(OH)2溶液和NaCl溶液
参考答案:D
本题解析:钠和水反应生成氢氧化钠和氢气,过氧化钠和水反应生成氢氧化钠和氧气,Ca(OH)2溶液和Na2CO3溶液反应生成碳酸钙和氢氧化钠,D中物质不反应,答案选D。
点评:该题是高考中的常见考点,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,同时兼顾学生能力的培养,难度不大,记住常见的化学反应即可。
本题难度:简单