1、实验题 化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;
第二:______________。
Na2O2跟水反应的化学方程式是________________________。
(2)某研究性学习小组拟用下图所示装置(气密性良好)进行实验,以证明上述结论。
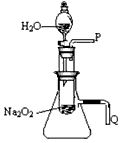
|
用以验证第一条结论的实验操作是:___________________________;用以验证第二条结论的实验方法是:______________________________。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。
请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)试剂:_______________________;现象:____________________________。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取
2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
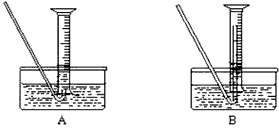
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的__________ (忽略导管在量筒中所占的体积)(填序号),理由是___________________。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为____________(选填“100mL”“200 mL”“500 mL”或“1000 mL”)。
参考答案:
(1)该反应是放热反应;2Na2O2+2H2O==4NaOH+O2↑
(2)打开分液漏斗活塞使水流入试管,再将带火星的木条靠近导管口P处,木条复燃,证明有O2生成;将导管Q浸入水中,反应过程中导管口有气泡冒出
(3)MnO2;气泡迅速产生,能使带火星的木条复燃
(4)①B;防止气体冷却时发生倒吸现象;②500mL
本题解析:
本题难度:困难
2、选择题 在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到室温,下列说法正确的是
[? ]
A.溶液中Na+浓度增大,有O2放出
B.溶液中OH-浓度不变,有H2放出
C.溶液中Na+数目减少,有O2放出
D.溶液中OH-浓度增大,有O2放出
参考答案:C
本题解析:
本题难度:一般
3、简答题 过氧化钠与水反应
参考答案:2Na2O2+2H2O=4NaOH+O2 ↑
本题解析:过氧化钠与水反应方程式:2Na2O2+2H2O=4NaOH+O2 ↑
本题难度:简单
4、选择题 有关物质燃烧时火焰颜色描述错误的是?(?)

A.氢气在氯气中燃烧——苍白色
B.钠在空气中燃烧——黄色

C.乙醇在空气中燃烧——淡蓝色
D.硫在氧气中燃烧——绿色
参考答案:D
本题解析:硫在空气中燃烧是淡蓝色火焰,而在氧气中燃烧是蓝紫色火焰,故D错。
本题难度:一般
5、实验题 Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为?而后又发生反应的离子方程式为?
在(Ⅱ)中煮沸溶液的目的是?
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是?。
(2)按该同学的设计,第(I)步实验装置如下:

①装置A使用的试剂是?(固体)和?;
②装置B使用的试剂最好是?(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是?,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有?。
参考答案:(13分)(1)2NaOH+ CO2= Na2CO3+H2O(1分)
CO32-+H2O+ CO2=2HCO3-(2分)
除去过量或多余的CO2气体,防止碳酸氢钠分解。(2分)
OH-+ HCO3-= CO32-+H2O(2分)
(2)①石灰石?盐酸(各1分)?②饱和碳酸氢钠溶液
除去CO2气体中混有的HCl气体(各1分)
NaCl? NaOH (各1分)
本题解析:
在(I)中,刚通入CO2时发生的反应化学方程为2NaOH+ CO2= Na2CO3+H2O而后又发生反应的离子方程式为CO32-+H2O+ CO2=2HCO3-
在(Ⅱ)中煮沸溶液的目的是除去过量或多余的CO2气体,防止碳酸氢钠分解。
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是OH-+ HCO3-= CO32-+H2O;①装置A使用的试剂是石灰石(固体)和盐酸;
②装置B使用的试剂最好是饱和碳酸氢钠溶液,作用是除去CO2气体中混有的HCl气体,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有NaCl? NaOH 2CO3制备实验
点评:此题考查学生对碳酸钠的熟练程度,特别注意的地方是:整个过程中对实验目的的把握。
本题难度:一般