1、计算题 已知T°、pkpa时,在容积为vL的密闭容器内充有1molA和1molB。保持恒温、恒压反应A(g)+B(g)  ?C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
?C(g)达到平衡时,C的体积分数为40%。试回答有关问题。
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA 2molB,则反应达到平衡时,容器的容积为??,C的体积分数为??。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1molA和1molB反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为??。
参考答案:(1)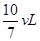 ? 40%?(2)
? 40%?(2)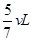
本题解析:(1)由于反应是在恒温恒压下进行的,而此时A和B的物质的量之比还是1︰1,所以平衡是等效的,即C的体积分数不变。?
A(g)+B(g)  ?C(g)
?C(g)
起始量(mol)? 1? 1? 0
转化量(mol)? x? x? x
平衡量(mol) 1-x 1-x? x
所以根据题意可知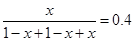
解得x=4/7mol
所以容器的容积是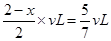
则如果通入2molA和2molB,平衡时容器的容积是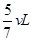 ×2=
×2=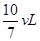 。
。
(2)根据(1)中的计算可知,平衡时容器的容积是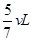 ,所以如果要保持恒温恒容建立平衡状态,且使平衡时C的体积分数仍然是40%,则最容器容积就应该是
,所以如果要保持恒温恒容建立平衡状态,且使平衡时C的体积分数仍然是40%,则最容器容积就应该是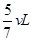 。
。
点评:该题的关键只正确理解等效平衡的含有,然后根据题中条件分清类别,用相应的方法求解即可。
本题难度:一般
2、选择题 在一定温度下,体积固定的密闭容器中进行可逆反应A(g) + 3B(g) 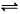 ?2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是?
?2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是?
A.单位时间内生成n mol A,同时生成3n mol B?
B.A、B、C的浓度不再发生变化
C.混合气体的压强不再发生改变
D.C生成的速率与C分解的速率相等
参考答案:A
本题解析:A.由于A、B都是反应物,所以在任何时刻都存在:单位时间内生成n mol A,同时生成3n mol B,因此不能作为判断反应是否达到平衡的标志,错误;B.若反应达到平衡,则各种物质的消耗速率与产生速率相等,即A、B、C的浓度不再发生变化。故可以作为判断反应达到平衡的标志,正确;C.由于该反应是反应前后气体体积不等的反应,所以混合气体的压强不再发生改变,则反应达到平衡,正确;D.若反应达到平衡,则C生成的速率与C分解的速率相等,正确。
本题难度:一般
3、选择题 PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g) PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
?
| PCl3(g)
| Cl2(g)
| PCl5(g)
|
初始浓度(mol/L)
| 2.0
| 1.0
| 0
|
平衡浓度(mol/L)
| c1
| c2
| 0.4
|
?
A.10 min内,v(Cl2) =" 0.04" mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的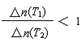
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
参考答案:C
本题解析:? PCl3(g)? +? Cl2(g)? ?PCl5(g)
?PCl5(g)
起始浓度:? 2.0? 1.0? 0
转化:?0.4? 0.4? 0.4
平衡浓度:? 1.6? 0.6? 0.4
A、10 min内,v(Cl2) =" 0.04" mol/(L·min),正确;B、当容器中Cl2为1.2 mol时,此时Cl2浓度为0.6 mol/L。反应达到平衡,正确;C、若升高温度(T1<T2)时,该反应平衡常数减小,表明该反应正向为放热反应,高温时PCl3的浓度改变量小,则平衡时PCl3的
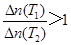 ,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
本题难度:一般
4、简答题 反应:3A(g)+B(g)=2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:则此反应在不同条件下进行最快的是( )
①v(A)=0.6mol?L-1?min-1;?②v(B)=0.45mol?L-1?min-1;
③v(C)=0.5mol?L-1?min-1;?④v(D)=0.45mol?L-1?min-1.
A.③
B.①
C.④
D.②
参考答案:3A(g)+B(g)=2C(g)+2D(g),
? 3? 1?2? 2
①v(A)=0.6mol?L-1?min-1;
②v(B)=0.45mol?L-1?min-1,则v(A)=0.45mol?L-1?min-1×3=1.35mol?L-1?min-1;
③v(C)=0.5mol?L-1?min-1,则v(A)=0.5mol?L-1?min-1×32=0.75mol?L-1?min-1;
④v(D)=0.45mol?L-1?min-1,,则v(A)=0.45mol?L-1?min-1×32=0.675mol?L-1?min-1;
显然②表示的该反应的反应速率最大,
故选D.
本题解析:
本题难度:一般
5、选择题 在一密闭烧瓶中充满NO2,在25℃时NO2与N2O4达到平衡: 2NO2(g)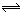 N2O4(g)?ΔH﹤0?把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是(?)
N2O4(g)?ΔH﹤0?把烧瓶置于100℃沸水中,又建立新的平衡状态,前后两平衡比较,不变的是(?)
A.颜色
B.平均分子量
C.物质的量
D.密度
参考答案:D
本题解析:升高温度,平衡向逆反应方向进行,NO2的浓度增大,颜色加深,因此选项A、B、C都是变化的。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以正确的答案选D。
本题难度:一般