1、填空题 (10分)、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)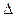 H1
H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)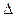 H2
H2
①上述反应符合“原子经济”原则的是?(填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
由表中数据判断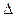 H1?0(填“>”“=”或“<”);
H1?0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为?.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应Ⅰ进行甲醇合成,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应 到某时刻测得各组分的浓度如下:
到某时刻测得各组分的浓度如下:
物质
| H2
| CO
| CH3OH
|
浓度/(mol·L-1)
| 0.2
| 0.1
| 0.4
|
①比较此时正、逆反应速率的大小:v正?v逆(填“>”、“<”或“=”)。
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =?mol·(L·min)-1。
(3)生产过程中,合成气要进行循环,其目的是?。
参考答案:(10分)、⑴①Ⅰ(1分)?② <?(1分)?③ 80% (2分)
(2)①>?(2分)?②0.03 mol·L-1·min-1。(2分)
(3)提高原料利用率(或提高产量、产率亦可)。(2 分)
分)
本题解析:略
本题难度:一般
2、计算题 (共16分)
(1)现有反应:mA(g)+nB(g)  ?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为______反应(填“吸热”或“放热”),且m+n______ p (填“>”、“=”或“<”)。
②减压使容器体积增大时,A的质量分数________。(填“增大”、“减小”或“不变”,下同)
③若容积不变加入B,则A的转化率__________,B的转化率________。
④若升高温度,则平衡时B、C的浓度之比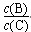 ?将________。
?将________。
⑤若加入催化剂,平衡时气体混合物的总物质的量________________________________
(2)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
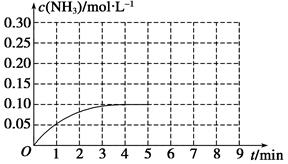
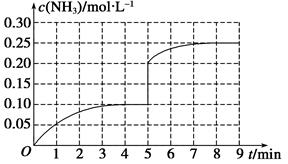
在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
参考答案:(1)①放热 > ②增大 ③增大 减小 ④减小 ⑤不变
(2)如图
本题解析:(1)反应:mA(g)+nB(g)  ?pC(g),达到平衡后,当升高温度时,B的转化率变大,说明正向移动,为吸热反应;当减小压强时,混合体系中C的质量分数减小,则平衡左移,正反应的气体系数减小。则:
?pC(g),达到平衡后,当升高温度时,B的转化率变大,说明正向移动,为吸热反应;当减小压强时,混合体系中C的质量分数减小,则平衡左移,正反应的气体系数减小。则:
②减压平衡逆向移动,A的质量分数增大
③若容积不变加入B,平衡右移,则A的转化率增大,而B的转化率减小。
④升高温度,则平衡正向移动,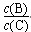 ?将减小。
?将减小。
⑤若加入催化剂,平衡不受影响,气体混合物的总物质的量不变
(2)_?N2(g)?+?3H2(g)? ?2NH3(g)
?2NH3(g)
初c:? 0.1? 0.3? 0
5min时c: 0.05? 0.15? 0.1
此时缩小容器体积一半,各物质浓度同倍数增大一倍,相当于增压,平衡正向移动。
_?N2(g)?+?3H2(g)? ?2NH3(g)
?2NH3(g)
5min时c: 0.1? 0.3? 0.2
8 min时c:? 0.25
本题难度:一般
3、选择题 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
[? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025 Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
参考答案:D
本题解析:
本题难度:简单
4、选择题 .能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是?
A.将水加热煮沸,测得pH=6
B.向纯水中投入一小块金属钠
C.向水中加入NH4Cl固体
D.向水中加入Na2CO3固体
参考答案:C
本题解析:A?将水加热煮沸,虽然pH=6,但成中性,c(H+)=c(OH-)
B 2Na+2H2O=2NaOH+H2溶液成碱性 c(H+)<c(OH-)
C 向水中加入NH4Cl固体? NH4+水解显酸性c(H+)>c(OH-)
D 向水中加入Na2CO3固体,CO32-水解,溶液显碱性 c(H+)<c(OH-)
本题难度:简单
5、选择题 合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的N2(g)+3H2(g) 2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如上图所示。下列叙述正确的是
2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如上图所示。下列叙述正确的是
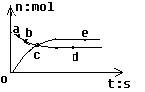
A.a点的正反应速率比b点的小
B.d点和e点n(N2)不相等
C. c点反应达平衡
D. d点的正反应速率与e点正反应速率相等
参考答案:D
本题解析:略
本题难度:简单