1、选择题 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
(1)过滤?(2)加过量的NaOH溶液 (3)加适量HCl (4)加过量的Na2CO3溶液
(5)加过量的BaCl2溶液
A.(2)(3)(4)(5)(1)
B.(4)(1)(2)(5)(3)
C.(2)(5)(4)(1)(3)
D.(5)(2)(4)(3)(1)
参考答案:C
本题解析:Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此正确的顺序可以是②⑤④①③,答案选C。
本题难度:一般
2、选择题 在实验室,称取一定量的粗盐经溶解、过滤、结晶等操作,可得到较纯净的食盐。下列图示对应的操作不规范的是
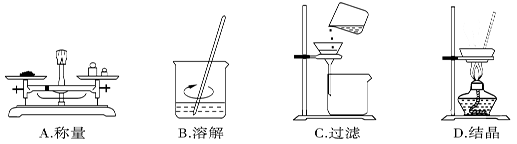
参考答案:C
本题解析:A、托盘天平称量固体时,符合左物右码的原则,指针指向分度盘的中间,正确;B、固体溶解时用玻璃棒搅拌加速溶解,正确;C、过滤时未用玻璃棒引流,错误;D、蒸发时用玻璃棒搅拌防止液体溅出,正确,答案选C。
本题难度:一般
3、选择题 下列实验装置不适用于物质分离的是
[? ]
A.
B.
C.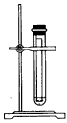
D.
参考答案:D
本题解析:
本题难度:简单
4、简答题 I.常压下乙醇的沸点为78.5℃,乙酸的沸点为118℃,以下是分离乙醇、乙酸的方案,请填空[(1)(3)是药品,(2)(4)是操作名称]
填空:(1)______(3)______(4)______
II.下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;A中的反应为2H2O2=2H2O+O2↑?).

回答下列问题:
(1)A装置中a仪器的名称______,b中盛放的物质是______(填化学式).
(2)若去掉B装置会对什么元素的测量结果有影响?______(填元素符号)
(3)E装置中所盛放物质最好选用______(选填:①氢氧化钙溶液?②氢氧化钠溶液③水)?
(4)若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种).经充分?燃烧后,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为______(填元素符号).
参考答案:I?实验室分离乙醇和乙酸,为达到较好的分离效果,可在混合液中加入氧化钙或氢氧化钠是乙酸生成盐,进行蒸馏分离可分离乙醇和乙酸盐,乙酸为弱酸,加入硫酸后在蒸馏条件下可的乙酸.
故答案为:(1)氧化钙或氢氧化钠;(3)浓硫酸或硫酸溶液;(4)蒸馏;
II.:(1)结合课本可知该仪器为锥形瓶,根据题意:A中的反应为2H2O2?MnO2?.?2H2O+O2↑,双氧水是液体,二氧化锰是固体,故答案为:锥形瓶;H2O2;
(2)分析实验设计思路可知,B装置是用来吸收A中的水蒸气,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响,故答案为:H;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳,故答案为:②;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素、氧元素的质量分别为:
1.44g×218×100%=0.16g,1.44g×1618×100%=1.28g.
3.52g二氧化碳中碳元素的质量为:3.52g×1244×100%=0.96g.
有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g.由此说明该样品中只含有碳元素和氢元素.
故答案为:C和H.
本题解析:
本题难度:一般
5、填空题 (1)化学实验中,常用沉淀法对溶液中的阳离子处理成沉淀进行分离.某溶液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用OH-、CO32-、Cl-三种不同阴离子使上述金属阳离子逐一形成沉淀.加入阴离子的顺序是:______
(2)有5瓶白色固体试剂,分别是Ba(NO3)2、KCl、NaOH、CuSO4、Na2SO4,现只提供蒸馏水,通过下面的实验步骤可鉴别它们.请填写下列空白:各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察则可鉴别出一种物质,被检出的物质的化学式是______
(3)在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O的反应中,氧化剂是______,还原产物是______,试用双线桥法表示上述氧化还原反应______.
参考答案:(1)AgCl、Cu(OH)2、AgOH、Ag2CO3、CuCO3、BaCO3等物质都是难溶或微溶于水的物质,如先加入CO32-,则三种金属离子都生成沉淀,如先加入OH-离子,则会同时生成Cu(OH)2和AgOH沉淀,而先加入Cl-,则只生成AgCl沉淀,然后加入OH-,生成Cu(OH)2沉淀,最后加入CO32-,生成BaCO3沉淀,所以加入阴离子的顺序是Cl-、OH-、CO32-;
故答案为:Cl-、OH-、CO32-;
(2)硫酸铜溶于水形成蓝色溶液,而Ba(NO3)2、KCl、NaOH、Na2SO4溶于水形成无色溶液,所以加入适量蒸馏水,振荡试管,观察则可鉴别出CuSO4;
故答案为:CuSO4;
(3)化合价降低元素Cl所在的反应物氯酸钾是氧化剂,化合价降低的元素Cl所在的产物Cl2是还原产物Cl2;KClO3+6HCl═3Cl2+3H2O+KCl,元素化合价升高值等于元素化合价降低值=电子转移数=5,电子转移情况为: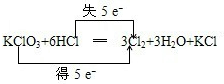 ;
;
故答案为:KClO3;Cl2; .
.
本题解析:
本题难度:一般