1、选择题 在容积为2L的密闭容器中,有反应:mA(g)+nB(g)
pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为A减少为a?mol/L,B的平均反应速率VB=a/15?mol/(L?min),C增加2a/3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )
A.3:1:2:2
B.1:3:2:2
C.1:3:2:1
D.1:1:1:1
参考答案:5min内,VB=a15mol/(L?min),故△c(B)=a15mol/(L?min)×5min=a3mol/(L?min),浓度变化量之比等于化学计量数之比,故m:n:p=a?mol/L:a3mol/(L?min):2a3mol/(L?min)=3:1:2,增加系统压强,A与C的百分含量不变,说明平衡不移动,故反应前后气体的物质的量不变,即m+n=p+q,故3+1=2+q,故q=2,所以m:n:p:q=3:1:2:2,
故选A.
本题解析:
本题难度:一般
2、填空题 (11分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,该反应的热化学方程式为 。
(2)298 K时,在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
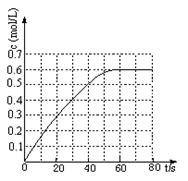
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.3" mol·mol-1,n(N2O4)="0.6" mol·mol-1,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
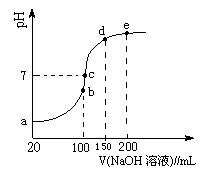
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
参考答案:(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1 (2分)
(2) ①6.67 (2分) ② a(2分) ③ < (2分) (3)①NH4+(1分)
②c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)(2分,前面不等式顺序正确1分,后面等号正确1分)
本题解析:(1)已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则1mol燃料完全燃烧释放出的热量是42.5kJ×60=2550kJ,所以该反应的热化学方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1。
(2)①根据图像可知平衡时N2O4的浓度是0.6mol/L,由于达平衡时,N2O4的浓度为NO2的2倍,则NO2浓度是0.3mol/L,所以该温度下平衡常数K= 。
。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终不变,即混合气体的密度保持不变不能说明反应达到平衡状态,a正确;b、颜色深浅和浓度有关系,所以混合气体的颜色不再变化发生说明反应达到平衡状态,b错误;c、正方应是体积减小的可逆反应,因此压强是减小的,当气压恒定时可以说明反应达到平衡状态,c错误,答案选a。
③某时刻测得n(NO2)="0.3" mol·mol-1,n(N2O4)="0.6" mol·mol-1,则此时浓度商= 。正方应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,所以此时浓度商大于平衡常数,则反应向逆反应方向进行,即正反应速率小于逆反应速率。
。正方应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,所以此时浓度商大于平衡常数,则反应向逆反应方向进行,即正反应速率小于逆反应速率。
(3)①b点加入的氢氧化钠是100ml,恰好与溶液中的氢离子中和,因此所得溶液是硫酸钠和硫酸铵的混合液,则水解的离子是NH4+。
②c点氢氧化钠溶液的体积小于150ml而大于100ml,这说明所得溶液是硫酸钠、硫酸铵以及氨水的混合液。pH=7溶液显中性,则溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
考点:考查热化学方程式书写、平衡状态判断、计算以及溶液中离子浓度大小比较
本题难度:困难
3、选择题 A、B、C为三种的气体,把a mol A和b mol B充入一密闭容器中,发生反应A+2B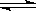 2C,达到平衡时,若它们的物质的量满足n(A)+ n(B)= n(C),则A的转化率为
2C,达到平衡时,若它们的物质的量满足n(A)+ n(B)= n(C),则A的转化率为
A.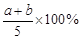 B.
B.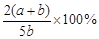
C.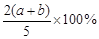 D.
D.
参考答案:D
本题解析:设A的转化率为x,根据方程式有:
A + 2B 2C,
2C,
起始(mol) a b 0
变化(mol) ax 2ax 2ax
平衡(mol) a-ax b-2ax 2ax 平衡时n(A)+ n(B)= n(C),则a-ax+ b-2ax=" 2ax" 得:x=(a+b)/5a
考点:化学平衡中物质转化率的计算。
本题难度:一般
4、选择题 下列说法中正确的是( )
A.物质发生化学反应时不一定都伴随着能量变化
B.伴有能量变化的变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
D.反应热只与反应体系的始态和终态有关,而与反应的途径无关
参考答案:D
本题解析:
本题难度:简单
5、填空题 (16分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:

合成塔中反应的化学方程式为 ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了 。
虑温度对反应速率的影响外,还主要考虑了 。
从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)。
A.过滤
B.分液
C.蒸馏
D.结晶
