1、选择题 已知: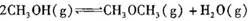
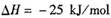 ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:

下列说法正确的是
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)="1.6" mol/L
C. 平衡
参考答案:
本题解析:
本题难度:一般
2、实验题 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
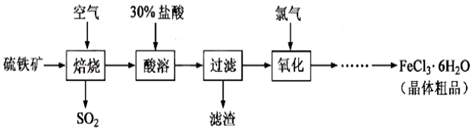
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
参考答案:(1) SO2+NaOH=NaHSO3;
SO2+NaOH=NaHSO3;
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+ Cl2 HCl
本题解析:(1)根据化学平衡常数概念写出平衡常数表达式;在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为
2SO3(g) ,该反应的平衡常数表达式为 ;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。
;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3;(2)根据题给流程知,酸溶的目的是将氧化铁转化为氯化铁,盐酸可抑制铁离子水解,酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、抑制Fe3+水解。(3)通氯气氧化的目的是将亚铁离子氧化为铁离子,发生的主要反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为Cl2、HCl。
考点:以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程为载体考查平衡常数表达式的书写、物质的分离和提纯。
本题难度:困难
3、填空题 可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答
cC(g)+ dD(g);根据图回答

(1)压强P1比P2____(填大或小);
(2)(a +b)比(c +d)____(填大或小);
(3)温度t1℃比t2℃____(填高或低);
(4)正反应为____反应。
参考答案:(1)小
(2)小
(3)高
(4)吸热
本题解析:
本题难度:一般
4、填空题 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
(1)已知:
参考答案:
本题解析:
本题难度:困难
5、选择题 已知反应A2(g)+2B2(g) 2AB2(g);△H<0,下列说法正确的是
2AB2(g);△H<0,下列说法正确的是
[? ]
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
参考答案:B
本题解析:
本题难度:一般