1、实验题 (6分)除去下列物质中的杂质,将所用试剂和分离操作的名称填入下表(括号中物质为杂质)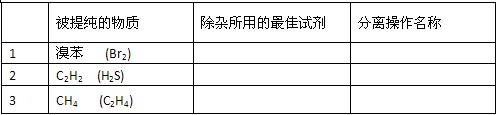
2、选择题 某同学利用土法制碱法[Na2CO3+Ca(OH)2=2NaOH+CaCO3↓]制取少量的烧碱,反应后要将溶液和沉淀分离,必需用到下列哪种仪器( )
A.
B.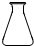
C.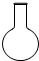
D.
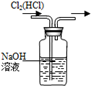
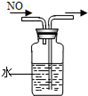
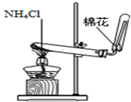
3、选择题 下列装置所示的实验中,能达到实验目的是
| 
| 
| 
|
A.分离碘酒中的碘和酒精
| B.除去Cl2中的HCl
| C.排水集气法收集NO
| D.实验室制氨气
|
?
4、选择题 利用下列实验装置完成相应的实验,操作正确且能达到实验目的的是( )
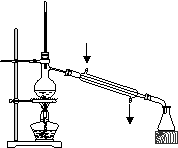 ?
? 
A.实验室中制取少量蒸馏水
B.从NaCl溶液提取NaCl固体

C.检验Na2CO3溶液中是否混有Na2SO4
D.配制200mL 0.10 mol·L-1盐酸
5、简答题 锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.以下是工业生产流程.请回答有关问题:
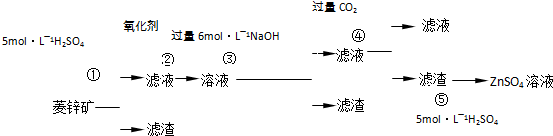
Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的______(填序号),理由是______.
?A.Cl2? B.H2O2? C.KMnO4? D.浓HNO3
(2)写出反应④的离子方程式:______.
(3)为了达到综合利用、节能减排的目的,上述流程中步骤______产生的______可以用于步骤______(其中步骤选填①、②、③、④、⑤).
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
重晶石(BaSo4)矿粉、煤粉
BaS+CO↑BaS溶液
(4)煅烧还原的热化学方程式为:______.
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)______.
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是______.