1、实验题 (6分)除去下列物质中的杂质,将所用试剂和分离操作的名称填入下表(括号中物质为杂质)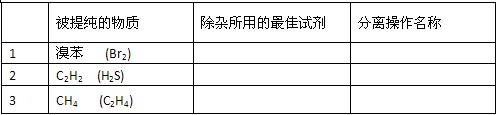
参考答案:1.? NaOH溶液?分液
2. NaOH溶液或CuSO4?溶液?洗气?3. 溴水?洗气
本题解析:1.向混合液中加入NaOH溶液:Br2+2NaOH=NaBr+NaBrO+H2O,溴苯与水溶液分为两层,可分液除去水层。
2.H2S气体可被硫酸铜溶液吸收除去:CuSO4+H2S=CuS↓+H2SO4(当然也可用碱液吸收)
3.可用溴水吸收乙烯:CH2=CH2 + Br2→CH2BeCH2Br。
本题难度:一般
2、选择题 某同学利用土法制碱法[Na2CO3+Ca(OH)2=2NaOH+CaCO3↓]制取少量的烧碱,反应后要将溶液和沉淀分离,必需用到下列哪种仪器( )
A.
B.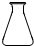
C.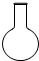
D.
参考答案:反应后要将溶液和沉淀分离,应用过滤的方法,过滤需要的玻璃仪器有烧杯、玻璃棒以及漏斗,则D正确.
故选D.
本题解析:
本题难度:简单
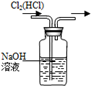
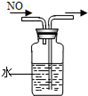
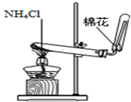
3、选择题 下列装置所示的实验中,能达到实验目的是
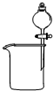
| 
| 
| 
|
A.分离碘酒中的碘和酒精
| B.除去Cl2中的HCl
| C.排水集气法收集NO
| D.实验室制氨气
|
?
参考答案:C
本题解析:A、碘易溶在酒精中,应该用四氯化碳萃取,A不正确;B、氢氧化钠溶液也吸收氯气,应该用饱和食盐水,B不正确;C、NO不溶于水且易被氧气氧化,可以用排水法收集,C正确;D、加热氯化铵生成氯化氢和氨气,冷却后二者又化合生成氯化铵得不到氨气,D不正确,答案选C。
本题难度:一般
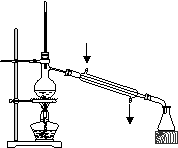
4、选择题 利用下列实验装置完成相应的实验,操作正确且能达到实验目的的是( )
 ?
? 
A.实验室中制取少量蒸馏水
B.从NaCl溶液提取NaCl固体
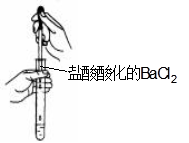

C.检验Na2CO3溶液中是否混有Na2SO4
D.配制200mL 0.10 mol·L-1盐酸
参考答案:B
本题解析:A中应该是下口进水,上口出水,A不正确;C中滴定管不能插入中试管中滴加溶液,不正确;D不正确,应该用200ml容量瓶,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强。该题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单
5、简答题 锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.以下是工业生产流程.请回答有关问题:
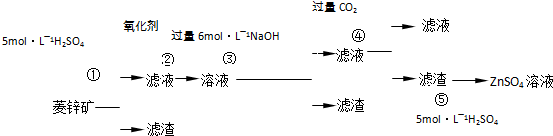
Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的______(填序号),理由是______.
?A.Cl2? B.H2O2? C.KMnO4? D.浓HNO3
(2)写出反应④的离子方程式:______.
(3)为了达到综合利用、节能减排的目的,上述流程中步骤______产生的______可以用于步骤______(其中步骤选填①、②、③、④、⑤).
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
重晶石(BaSo4)矿粉、煤粉
BaS+CO↑BaS溶液
(4)煅烧还原的热化学方程式为:______.
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)______.
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是______.
参考答案:(1)ZnCO3,FeCO3、Cu2(OH)2CO3都能溶液足量5mol/L硫酸溶液中,生成ZnSO4,FeSO4,CuSO4,CO2,H2O;SiO2不溶于硫酸,步骤①得到滤渣为SiO2;滤液为ZnSO4,FeSO4,CuSO4,H2O;步骤②用氧化剂是氧化亚铁离子;
A、氯气做氧化剂氧化亚铁离子会引入氯离子,且氯气有毒,故A不选;
B、过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热胡分解生成氧气和水,故B正确;
C、KMnO4 做氧化剂会引入K+,MnO4-,故C错误;
D、浓HNO3做氧化剂会被还原为有毒气体NO2,引入杂质离子NO3-,故D错误;
故答案为:B;不会引入新的杂质离子;
(2)偏铝酸钠溶液中通入二氧化碳气体会生成氢氧化铝沉淀,由此推断步骤④发生的反应是Na2ZnO2,NaOH和二氧化碳反应滤渣为Zn(OH)2,滤液为NaHCO3,反应的离子方程式为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-,故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(3)步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排,故答案为:①;CO2;④;
(4)①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
②C(s)+12O2(g)=CO(g);△H=-110.5kJ?mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
依据盖斯定律②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2?kJ?mol-1;
(5)经检验BaS的水溶液呈碱性说明硫离子水解的原因,反应的离子方程式为S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(6)若步骤⑤为氢氧化锌和改过了硫酸反应,所得溶液中含有硫酸锌和硫酸,与BaS反应可以制的锌钡白,同时过量硫酸和BaS反应生成有毒气体H2S污染空气,减少锌钡白的产量,
故答案为:酸性过强,与BaS溶液混合是可能产生H2S气体污染,或锌钡白的产率会降低.
本题解析:
本题难度:一般